某离子反应涉及H2O、ClO-、NH4+ 、H+、N2、Cl-六种微粒。其中c(NH4+ )随反应进行逐渐减小。下列判断正确的是
| A.反应的还原产物是N2 |
| B.消耗1 mol氧化剂,转移电子3 mol |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
某二价金属的碳酸盐和酸式碳酸盐的混合物,跟足量的稀盐酸反应,消耗H+和生成CO2物质的量之比为6:5,则该混合物中碳酸盐和酸式碳酸盐的物质的量之比是 ( )
| A.1:1 | B.1:2 | C.1: 3 | D.1:4 |
由钾和氧组成的某种离子晶体含钾质量分数为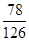 ,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
| A.1∶1 | B.2∶1 | C.1∶2 | D.1∶3 |
将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是
| A.硫酸铜的溶解度 |
| B.溶液的质量 |
| C.溶液中溶质的质量分数 |
D.溶液中Cu 的数目 的数目 |
某同学将某种金属分别与等体积的甲、乙两种溶液反应,所加金属的质量与相同条件下产生气体的体积关系如图所示,下列推论可能正确的是( )
| A.金属是镁,甲溶液为0.2 mol/L盐酸,乙溶液为0.1 mol/L盐酸 |
| B.金属是铁,甲溶液为pH=1的醋酸溶液,乙溶液为pH=1的盐酸 |
| C.金属是铝,甲溶液为0.1 mol/L盐酸,乙溶液为0.1 mol/L氢氧化钠溶液 |
| D.金属是铝,甲溶液为0.1mol/L氢氧化钠溶液,乙溶液为0.1 mol/L盐酸 |
下列各组在溶液中反应,由于反应物的量不同,而不能用同一离子方程式表示的是( )
| A.SO2与NaClO | B.Ba(OH)2与H2SO4 |
| C.HCl与NaHCO3 | D.Ca(HCO3)2与Ca(OH)2 |