铝分别与足量的稀硫酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况体积相等时,反应中消耗的H2SO4和NaOH物质的量之比为( )
| A.1:4 | B.2:3 | C.3:2 | D.4:1 |
将甲苯与液溴混合,加入铁粉,其反应产物可能有( )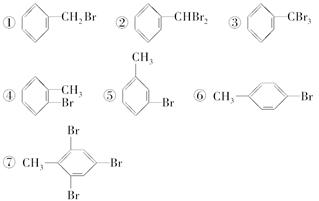
| A.仅①②③ | B.仅⑦ | C.④⑤⑥⑦ | D.全部都有 |
25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃8mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了18mL,原混合烃中乙炔的体积分数为( )
| A.12.5% | B.25% | C.50% | D.75% |
NA为阿伏加德罗常数,下列说法正确的是()
| A.标准状况下,11.2L的戊烷所含的分子数为0.5NA |
| B.28g乙烯所含共用电子对数目为4NA |
| C.标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA |
| D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
某烃在光照的条件下与氯气反应能生成三种不同的一氯代物,1 mol它在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下),它该烃的结构简式是( )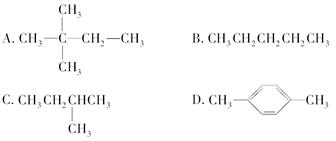
下列有机物系统命名正确的是()
A.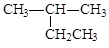 2-乙基丙烷 2-乙基丙烷 |
| B.CH3CH2CH2CH2OH 1-丁醇 |
C.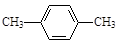 对二甲苯 对二甲苯 |
D.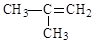 2-甲基-2-丙烯 2-甲基-2-丙烯 |