海水中蕴藏着丰富的资源,海水综合利用的流程图如下:

(一)某化学研究小组用右图装置模拟步骤I电解食盐水(用铁和石墨做电极)。

(1)a电极材料是 (填铁、石墨),其电极反应式为 。
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为 (忽略反应前后溶液体积的变化)。
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+。下表是生成氢氧化物沉淀的pH:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
8.1 |
3.8 |
9.5 |
| 完全沉淀pH |
3.7 |
9.6 |
4.8 |
11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是______________(填序号,下同),加入
调节溶液的pH,充分反应后过滤,可得MgCl2溶液。
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2·H2O获得MgCl2的操作是: 。
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是 。
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式: 。
在一条鱼虾几乎绝迹的小河边从上游到下游依次有四座工厂,甲、乙、丙、丁四厂排放的废液中含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种;某中学环保小组对河水检测时发现:甲处河水呈乳白色,乙处河水呈红褐色,丙处河水变浑浊,丁处产生气泡,河水仍然澄清。试回答:
(1)四处河水排放的污染物分别是:甲________,乙________,丙________,丁________。
(2)在丁处的下游取出的河水中,肯定含有的离子是_____________________________。
(3)小河中鱼虾绝迹的原因是_______________________________________________。
某城市用水中含c(Ca2+)为1.0×10-3 mol·L-1,c(Mg2+)为5.0×10-4 mol·L-1,c(HCO3-)为8.0×10-4 mol·L-1。如用药剂软化该水1 000 L,应加入Ca(OH)2________g,Na2CO3________g;如果水中含Mg2+,加入Na2CO3后,为尽量减少水中的Mg2+的浓度,可将水加热至沸,加热时反应的化学方程式为________。
海水资源的利用具有非常广阔的前景。
(1)海水淡化的主要方法有(只写出1种即可)________。
(2)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可以制备多种化工产品。
①用石墨电极电解饱和食盐水时,阴极的电极反应式是
_______________________________________________________________。
②常温下,用石墨电极电解饱和食盐水,当阴极产生的气体体积为112 mL(已折算为标准状况)时停止电解,此时溶液体积为1 L,若忽略气体的溶解,最终溶液的pH约为________。
地球的海水总量约有1.4×1018 t,是人类最大的资源库
(1)如图利用海水得到淡水的方法为________。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图: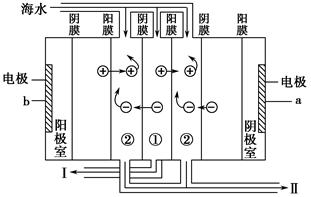
a是电源的________极;I口排出的是________(填“淡水”或“浓水”)。
(3)海水淡化后的浓水中含大量盐分,排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产。
①电解前需要把浓水精制,加入试剂的顺序为___________________________________;
②用离子交换膜电解槽电解食盐水的化学方程式为
_________________________________________________________________________________________________________________________________。
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在,每吨海水只含3.3 mg铀,海水总量极大,铀总量相当巨大。不少国家正在探索海水提铀的方法。现在,已经研制成功了一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素。其反应原理为________(树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为_______________________________________________________________________________________________________________________________。
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题。
(1)天然水中溶解的气体主要有________、________;
(2)天然水在净化处理过程中加入的混凝剂可以是 ____________其净水作用的原理是________________________________________________________________;
(3)水的净化与软化的区别是____________________________________________
(4)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO)。若某天然水中c(Ca2+)=1.2×10-3 mol·L-1,c(Mg2+)=6×10-4 mol·L-1,则此水的硬度为________;
(5)若(4)中的天然水还含有c(HCO3-)=8×10-4 mol·L-1,现要软化10 m3这种天然水,则需先加入Ca(OH)2________ g,后加入Na2CO3________g。