某学习小组利用下列装置进行 CO2与饱和 Na2CO3溶液反应制备 NaHCO3。
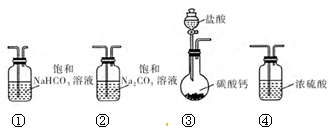
(1)选取必要的实验装置,正确的连接顺序为 (填序号)。
(2)为确定制得的固体样品是纯净的 NaHCO3,小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象。
乙方案:将样品溶液与 BaCl2溶液反应,观察现象。
丙方案:测定 pH 法。
丁方案:热重分析法。
①判定甲方案 (填“可行”或“不可行”)。
②为判定乙方案的可行性,某同学用 NaHCO3分析纯配制的溶液,与 BaCl2溶液等体积混合进行实验,结果如下。
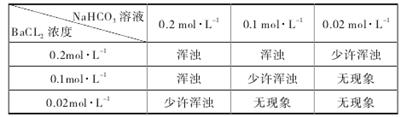
(i)此实验已可说明乙方案是不可行的。请结合以下数据,并通过计算说明产生浑浊的原因。答:__________________________________________________________。
[已知:0.1mol·L-1NaHCO3溶液电离出的 c(CO32-) 为0.0011mol·L-1,Ksp(BaCO3)=5.1×10-9]
(ii)产生浑浊的离子方程式_______________________________________。
③使用 pH 计测定的丙方案是______________________________________________。
④进行丁方案实验,得到不同升温速率下的热重曲线如下图。

(i)样品的纯度为_________________。
(ii)升温速率对实验结果______________(填“有较大”、“有较小”或“没有”)影响。
亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到。亚硝酰氯有关性质如下:
| 分子式 |
别名 |
熔点 |
沸点 |
溶解性 |
性状 |
| ClNO |
氯化亚硝酰 |
-64.5℃ |
-5.5℃ |
溶于浓硫酸 |
红褐色液体或有毒气体,具有刺激恶臭,遇水反应生成氮的氧化物与氯化氢 |
某研究性学习小组根据亚硝酰氯性质拟在通风橱中制取亚硝酰氯,设计了如图所示实验装置。实验开始前K2处于打开状态,K1、K3均已关闭。、
试回答下列问题:
(1)①若D中装有纯净的NO气体,则B中应选用的试剂为。实验时利用B除去某些杂质气体并通过观察B中的气泡来判断反应速率,B还具有的作用是;②若D中装有纯净的氯气,则C中应选用的试剂为。
(2)装置F的作用是;装置G的作用是。
(3)若无装置G,则F中ClNO可能发生反应的化学方程式为。
(4)某同学认为氢氧化钠溶液只能吸收氯气和ClNO,但不能吸收NO,所以装置H不能有效除去有毒气体。为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是。
阅读下列文字,填写文中带圈的数字后面的空白:
某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究。
(一)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:①;
原因Ⅲ:Cl-对反应具有促进作用,而 SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:②
(二)该同学取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
1.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
2.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验1中③,实验2中④,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
(三)为了使实验“定量化”、使结果更精确,可以对实验进行如下改进:
1.配制c(H+)相同的稀盐酸和稀硫酸:现有浓度为1mol·L-1的盐酸和密度为1.225g·cm-3、质量分数为20%的硫酸,若要准确量取该硫酸20.00mL,需要用⑤(填仪器名称);将量取的硫酸配制成c(H+)=1mol·L-1的溶液,可得溶液的体积为⑥。配制溶液时还需要用到的玻璃仪器有⑦、烧杯、胶头滴管和量筒等。
2.比较反应速率:反应时间可以用秒表测定。如果要对上述实验中的反应速率进行比较,可以通过测定哪些物理量来确定?⑧(要求回答一种即可)。
实验室用如图所示的装置制取乙酸乙酯.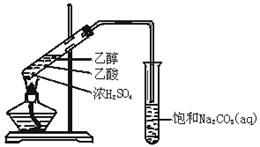
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是:,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是防止Na2CO3溶液的倒吸.造成倒吸的操作上的原因是。
(3)浓硫酸的作用是①;②.
(4)饱和Na2CO3溶液的作用是。
(5)乙酸乙酯的密度比水(填“大”或“小”),有味.
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是
(填物质名称).
(10分)江苏省拥有很长的海岸线,具有丰富的海洋资源,因此盐化工是本省的一个重要产业。从盐卤初步得到的光卤石(KCl·MgCl2·6H2O)晶体中,还含有约8%的NaCl。
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下: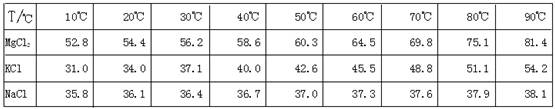
并设计出下面的实验流程: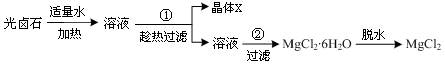
根据他们提供的数据和实验回答下列问题:
问题1:以上实验流程中晶体X的化学式为,若制得的X还含有少量的可溶性杂质,可用
的方法进一步提纯。操作步骤①中趁热过滤的原因是:
问题2:工业上采用电解无水氯化镁的方法制取金属镁。
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2·6H2O来得到无水MgCl2。装置中盛有浓硫酸的仪器分别
是(填写仪器的符号),需要加热的仪器是(同上)。
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳。请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂。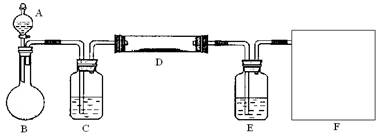
(14分) 某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。
请根据实验步骤,回答下列问题:
(17)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。竖直冷凝管的作用是_____________________。
(18)①理论上,上述反应的副产物可能有:丁醚、________________(填结构简式)、溴化氢、硫酸氢钠、水等。
②熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是__________;___________
③有同学通过某仪器鉴定所得产物中含有“-CH2CH2CH2CH3”,从而确定副产物中存在丁醚。该同学的观点___________(填“正确”或“错误”)原因是____________
_______________________________________。
(19)为了进一步分离、提纯1-溴丁烷,该兴趣小组同学查得相关有机物的有关数据如下:
请你补充下列实验步骤,直到分离出1-溴丁烷。
| 物质 |
熔点/℃ |
沸点/℃ |
| 1–丁醇 |
– 89.5 |
117.3 |
| 1–溴丁烷 |
– 112.4 |
101.6 |
| 丁醚 |
– 95.3 |
142.4 |
| 1–丁烯 |
– 185.3 |
– 6.5 |
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③______________________;
④接通冷凝管的冷凝水,使冷水从________处流入;
⑤迅速升高温度至____________℃收集所得馏分。
(20)若实验中所取1–丁醇、NaBr分别为7.4 g、13.0 g(浓H2SO4足量),蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g 1–溴丁烷,则1–溴丁烷的产率是____________。