实验室用如图所示的装置制取乙酸乙酯.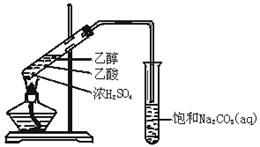
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是: ,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是防止Na2CO3溶液的倒吸.造成倒吸的操作上的原因是 。
(3)浓硫酸的作用是① ;② .
(4)饱和Na2CO3溶液的作用是 。
(5)乙酸乙酯的密度比水 (填“大”或“小”),有 味.
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是
(填物质名称).
【化学—选修2:化学与技术】
生态工业园区的建设,不仅仅是体现环保理念更要依据循环经济理论和充分考虑经济的可持续发展。下面是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产三大生态产业链流程图。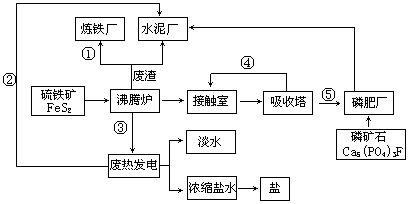
根据上述产业流程回答下列问题:
(1)从原料、能源、交通角度考虑该企业应建在( )
| A.西部山区 | B.沿海地区 | C.发达城市 | D.东北内陆 |
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式① ,② ,③ ,④ ,⑤ 。
(3)沸腾炉发生反应的化学方程式 ,磷肥厂的产品是普钙,其主要成份是 (填化学式)。
(4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可)。
(5)根据生态园区建设理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想 , (请写出两点)。
某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化。
(1)该同学最初的实验操作和现象如下:
| 编号 |
操作 |
现象 |
| I |
先向2 mL 0.1 mol/L FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 |
|
| II |
先向2 mL 0.1 mol/L FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol/L KI溶液 |
滴加KSCN溶液后,溶液变成红色;滴加KI溶液后,红色无明显变化 |
①实验I的现象为。
②FeCl2溶液与新制氯水反应的离子方程式为。
(2)该同学分析了导致实验II现象的可能原因,并对实验方案进行了改进。改进后的实验操作和现象如下:
| 编号 |
操作 |
现象 |
| III |
向2 mL 0.1 mol/L KI溶液中滴加1 mL 0.1 mol/L FeCl3溶液,再滴加KSCN溶液 |
滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成红色 |
根据实验III,甲同学认为Fe3+有可能与I-发生氧化还原反应,请结合实验现象用简明的文字说明他得出上述结论的理由。
(3)该同学认为需要进一步设计实验证明根据实验III中现象得出的结论。请补全下表中的实验方案。
| 编号 |
操作 |
预期现象及结论 |
| IV |
向2 mL 0.1 mol/L KI溶液中滴加1 mL 0.1 mol/L FeCl3溶液, |
现象: 结论: |
(4)上述实验结果表明,Fe3+确实与I-发生氧化还原反应。进一步查阅资料知,参加反应的Fe3+与I-的物质的量相同。该同学结合上述实验结论,分析了实验III中加入KSCN后溶液变红的原因,认为Fe3+与I-反应的离子方程式应写为
。
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是
N2O4(g)△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是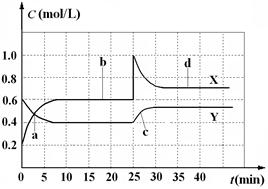
| A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化 |
| B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d |
| C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4 |
| D.若要达到与d相同的状态,在25 min时还可以采取的措施是适当缩小容器体积 |
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。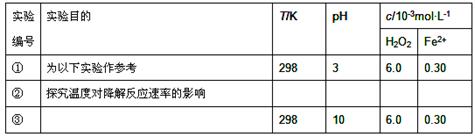
[数据处理]实验测得p-CP的浓度随时间变化的关系如图。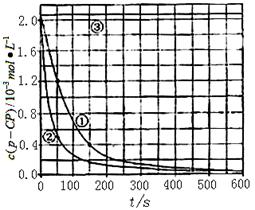
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率: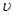 (p-CP)= mol·L-1·s-1
(p-CP)= mol·L-1·s-1
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度 过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
(4)实验③得出的结论是:pH等于10时,。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:。
某同学设计了以下操作流程来除去混在氯化钠固体中的少量硫酸钠和氯化钙。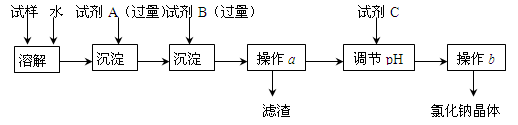
(1)试剂A是,试剂A需要过量的原因是。
(2)操作a得到的滤渣的成分是,在实验室中进行操作a需要的仪器是:铁架台(带铁圈)、滤纸、烧杯、 、。
(3)加入试剂C调节滤液pH的离子反应方程式是。
(4)该同学想利用上述得到的氯化钠设计一套实验装置来电解饱和食盐水,并检验氯气的氧化性和测定所产生的氢气的体积,部分装置如下图: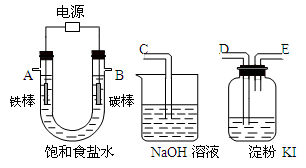
①碳棒接直流电源的_____极; 铁棒上发生的电极反应为。
②说明氯气具有氧化性的实验现象是。
③将上图中的仪器,连成一整套装置,各种仪器接口的连接顺(填编号)是B接,接。在答题卡的方框中画出与A接口连接的仪器的装置图。