配制一定体积、一定物质的量浓度的硫酸溶液时,下列情况使溶液浓度偏小的是
| A.容量瓶中原有少量蒸馏水 |
| B.定容时观察液面仰视 |
| C.用量筒量取浓硫酸后洗涤量筒 |
| D.稀释后未冷却至室温即定容 |
下列说法正确的是
| A.第ⅥA族元素从上到下,其氢化物的稳定性逐渐减弱 |
| B.L层电子数为奇数的所有元素都是非金属元素 |
| C.ⅦA族元素阴离子的还原性越强,元素的最高价氧化物对应水化物的酸性也越强 |
| D.同一主族的甲乙两种元素,甲的原子序数为a,则乙的原子序数可能为a+4 |
四种短周期元素W、X、Y、Z的原子序数依次递增,X的一种单质能在空气中自燃。电解含有Y和Z的阴离子的混合溶液时,在阳极Y离子先失去电子。W和Z同主族。对于这四种元素下列判断正确的是
| A.气态氢化物的稳定性:W>X>Y>Z |
| B.单质的氧化性:W>Z>Y>X |
| C.四种元素原子半径大小:W<Y<Z<X |
| D.W单质可以将Z从其盐溶液中置换出来 |
下列说法正确的是
| A.非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价 |
| B.只有非金属能形成含氧酸或含氧酸盐 |
| C.除稀有气体外的非金属元素都能生成不同价态的含氧酸 |
| D.非金属的最高价含氧酸都具有强氧化性 |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
| A.X、Y、Z中最简单氢化物稳定性最弱的是Y |
| B.Z元素氧化物对应水化物的酸性一定强于Y |
| C.X元素形成的单核阴离子还原性大于Y |
| D.Z元素单质在化学反应中只表现氧化性 |
四种短周期元素在周期表中的位置如右图,其中只有M为金属元素。下列说法不正确的是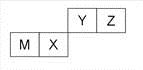
| A.原子半径Z<M |
| B.Y的最离价氧化物对应水化物的酸性比X 的弱 |
| C.X 的最简单气态氢化物的热稳定性比Z的小 |
| D.Z位于元索周期表中第2 周期、第ⅥA族 |