有关溶液中所含离子的检验,下列判断正确的是( )
| A.加入氯水,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有Fe3+存在 |
| B.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32-存在 |
| C.用某溶液做焰色反应实验时火焰为黄色,则该溶液中一定有钠元素,可能有钾元素 |
| D.分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐溶液,只用NaOH溶液是能一次鉴别开的 |
高纯度晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场 “革命”。它可以按下列方法制备: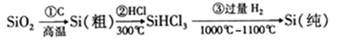
下列说法正确的是
A.步骤①的化学方程式为:SiO2+C Si+CO2↑ Si+CO2↑ |
| B.步骤①②③中每生成或反应1mol Si,转移4mol电子 |
| C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应 |
| D.SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3 |
根据下列实验操作和现象,结论正确的是
| 操作 |
实验现象 |
结论 |
|
| A |
向某溶液中加入氯化钡、稀硝酸的混合液 |
产生白色沉淀 |
该溶液中一定含有SO42-或SO32- |
| B |
将某气体通入品红溶液 |
溶液红色褪去 |
该气体一定SO2 |
| C |
把湿润的碘化钾——淀粉试纸放入某一红棕色的气体中 |
试纸变蓝色 |
该气体可能是NO2 |
| D |
将通入SO2到酸性高锰酸钾溶液中 |
溶液紫色褪去 |
SO2具有漂白性 |
下列反应的离子方程式正确的是
| A.用氨水吸收过量的二氧化硫:NH3·H2O+SO2=NH4++HSO3- |
| B.在澄清石灰水中通入少量二氧化碳:OH-+CO2=HCO3- |
| C.向溴化亚铁中通入少量氯气:2Br-+Cl2=2Cl-+Br2 |
| D.用氢氧化钠吸收多余的氯气:OH-+Cl2=2Cl-+HClO |
NA为阿伏伽德罗常数,下列叙述正确的是
| A.18gH2O中含有的质子数为NA |
| B.常温常压下,Na2O2与足量H2O反应,每生成1 molO2,转移电子的数目为4NA |
| C.46gNO2和N2O4混合气体中含有原子总数为3NA |
| D.物质的量浓度为0.5 mol·L-1的MgCl2的溶液中,含有Cl-个数为NA |
下列化学用语表示正确的是
A.S2-的离子结构示意图: |
| B.次氯酸的结构式:H—O—CI |
C.水分子的比例模型: |
D.NCI3的电子式: |