某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液。
其操作可分解为如下几步:
a. 移取20.00mL待测的NaOH溶液注入洁净的锥形瓶,并加入2-3滴酚酞
b. 用标准盐酸溶液润洗滴定管2-3次
c. 把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴充满溶液
d. 取标准盐酸溶液注入酸式滴定管至0刻度以上2-3cm
e. 调节液面至0或0刻度以下,记下读数
f. 把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)_____________________。
(2)滴定终点时溶液的颜色变化是 。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________。
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(4)若某次滴定开始和结束时,酸式滴定管中的液面如图所示,则反应消耗盐酸的体积为_____ mL。

(5)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH溶液的体积/mL |
0.1000mol/L盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.20 |
20.22 |
|
| 第二次 |
25.00 |
0.56 |
24.54 |
|
| 第三次 |
25.00 |
0.42 |
20.40 |
|
依据上表数据求得NaOH溶液的物质的量浓度为 (保留4位有效数字)。
有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。
研究小组通过实验确定样品的成分。
查阅资料知:Cu2O + 2H+=Cu + Cu2+ + H2O;
实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO至溶液的pH为4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH至溶液的pH为7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是。
(3)溶液C中除H+、Cu2+外一定还含有另一种阳离子,为验证存在该阳离子,可选用的试剂为,对应的现象是。
(4)Ⅳ中加NaClO的目的是。
(5)将Ⅳ中得到的溶液D电解,若电路中有0.1mol电子通过,则理论上阴极质量增重g。
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合1:;组合2:;组合3:(用化学式表示)
用含少量铁的氧化物的氧化铜制取硫酸铜晶体(CuSO4·xH2O)。有如下操作: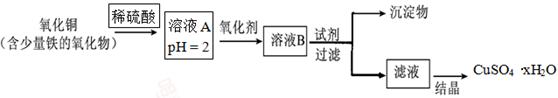
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂为(填编号,下同)。
a.KMnO4b.(NH4)2Sc.NaOHd.KSCN
(2)欲用(1)中选择的检验试剂测定溶液A中的Fe2+的浓度,下列滴定方式中(夹持部分略去),最合理的是(填序号)。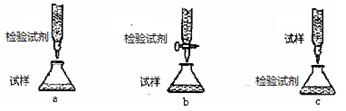
写出滴定反应的离子方程式 。
⑶在上述流程中,要得到较纯的产品,试剂可选用。
a.NaOH
b.FeO
c.CuO
d.Cu(OH)2
e.Cu2(OH)2CO3
⑷为了测定制得的硫酸铜晶体(CuSO4·xH2O)中 的值,某兴趣小组设计了实验方案:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为ng。据此计算得
的值,某兴趣小组设计了实验方案:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为ng。据此计算得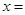 (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化。为了验证该结论,学生设计了如下图所示的实验装置进行实验(夹持装置略去)。圆底烧瓶A中的反应方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,请回答下列问题。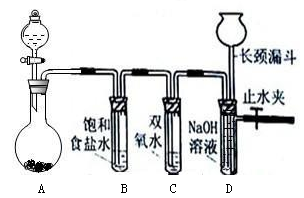
(1)试管B中饱和食盐水的作用;
(2)试管C中加入5mL 30% 双氧水,发生反应的化学方程式____________________;
(3)试管D中充满10% NaOH溶液,NaOH溶液的作用是;
(4)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管D中的现象为,试管D中的气体检验方法为_________________ 。
(14分)氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气。某研究性学习小组模拟生产企业制取氢化钙。
【实验】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。
(1)下列有关该实验的说法正确的是。
a.其他条件相同时,粗锌制取氢气的速率比纯锌快
b.加热时,必须通入氮气作为保护气,以防止空气的干扰
c.可以用浓硫酸或碱石灰对H2进行干燥除杂
d.开始实验时,应先通入H2,后给金属钙加热
e.已停止实验时,应先停止通入H2,后停止加热。
【提出假设】
(2)由于实验中操作不当,金属钙或氢化钙都可能被氧化。该小组甲同学对反应后的固体产物成分提出如下假设。
假设l:含有Ca 和CaH2。
假设2:含有CaH2和CaO。
假设3:含有。
【设计实验方案,验证假设】
(3)定性实验用化学方法鉴别Ca与CaH2,请设计实验完成下表中内容。
| 实验步骤(不要求写具体操作过程) |
预期现象和结论 |
| 取少量固体样品,… |
(4)定量实验测定Ca 和CaH2 混合物中CaH2的质量分数。
①取m1g样品与水完全反应,利用如图装置测定生成的气体体积时,在时进行收集(填字母)
a.刚开始有气泡时b.气泡连续均匀时 c.气体经过验纯后,再收集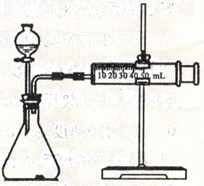
②如果装置气密性良好,操作正确,乙同学认为:由于液体加入,导致气体的体积测定偏大,则计算出氢化钙的质量分数(天“偏高”、“偏低”“无影响”)
【反思与交流】
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要讲金属钙制备成氢化钙呢?你的观点是。
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
(1)装置Ⅰ中产生气体的化学方程式为。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为(填序号)。
实验二葡萄酒中抗氧化剂残留量的测定
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果(填“偏高”“偏低”或“不变”)。