密闭容器中,反应xA(g) + yB(g) 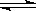 zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是( )
zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是( )
| A.x+y < z | B.平衡向正反应方向移动 |
| C.B的转化率升高 | D.C的体积分数下降 |
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为甲烷,然后将甲烷通入以KOH为电解质的燃料电池发电。电池负极反应为
| A.CH4-8e-+8OH-=CO2+6H2O |
| B.O2+4H++4e-=2H2O |
| C.CH4+10OH--8e-=CO32-+7H2O |
| D.O2+2H2O+4e-=4OH- |
下列有关说法正确的是
| A.反应NH3(g)+HCl(g)= NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C.CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大 |
| D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
在密闭容器中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c+d |
关于如图所示装置的叙述,正确的是
| A.铜是阳极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.铜离子在铜片表面被还原 |
25℃时,水中存在电离平衡:H2O  H++OH- △H>0。下列叙述正确的是
H++OH- △H>0。下列叙述正确的是
| A.将水加热,KW增大,pH不变 |
| B.向水中加入少量NaHSO4固体,c(H+)增大,KW不变 |
| C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |