向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。 向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是( )。
A. |
B.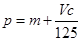 |
| C.n=m+0.017Vc | D.n=p+ ×2 ×2 |
A、B分别为第3周期和第4周期的同一主族不同元素的原子,它们原子核内质子数都等于中子数。①若A为ⅡA族,其质量数为x,则B的质子数为y。若A为ⅣA族,其质子数为m,则B的质量数为n。在下列各组值中,y和n的值分别是( )
A.(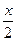 +18)和(2m+18) B.(
+18)和(2m+18) B.(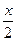 +8)和(2m+8)
+8)和(2m+8)
C.(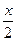 +8)和(2m+36)D.(
+8)和(2m+36)D.(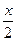 +18)和(2m+18)
+18)和(2m+18)
X、Y两元素的原子分别获得一个电子后能形成稀有气体的电子层结构,且X放出的能量大于Y,下列叙述错误的是( )
| A.还原性:X->Y- | B.氧化性:Y<X |
| C.原子序数:X<Y | D.还原性:X-<Y- |
某元素一种同位素原子的质子数为m,中子数为n,则下述论断正确的是( )
| A.不能由此确定该元素的相对原子质量 |
| B.这种元素的相对原子质量为m+n |
| C.若碳原子质量为W克,此原子的质量为(m+n)W克 |
| D.核内中子的总质量小于质子的总质量 |
第7周期为不完全周期,若将来把这一周期元素全部排满,则下列有关第7周期元素的推论可能错误的是( )
| A.第7周期排满时有32种元素,全部是放射性元素 |
| B.第7周期排满时最后一种元素的单质不与任何物质发生化学反应 |
| C.第7周期第ⅦA族元素的原子序数为117,是一种金属元素 |
| D.第7周期第ⅢA族元素的氢氧化物与Al(OH)3具有相似的化学性质 |
下列说法中错误的是( )
| A.原子及其离子的核外电子层数等于该元素所在的周期数 |
| B.元素周期表中从Ⅲ B族到ⅡB族10个纵行的元素都是金属元素 |
| C.除氦外的稀有气体原子的最外层电子数都是8 |
| D.同一元素的各种同位素的物理性质、化学性质均相同 |