氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。下列生产、生活中的实例中发生了氧化还原反应的是
体积比为2∶3的N2和H2的混合气体,在一定条件下发生反应。达到平衡时,容器内压强为反应开始时的 ,则N2的转化率为
,则N2的转化率为
| A.50% | B.37.5% | C.25% | D.12.5% |
在重铬酸钾(K2Cr2O7)溶液中存在如下平衡: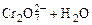



 , 向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
, 向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
| A.Ag2O | B.Ag2CrO4 | C.AgHCrO4 | D.Ag2Cr2O7 |
升高温度反应速度加快的主要原因是
| A.分子运动速度加快 | B.活化能增加 |
| C.体系能量增加 | D.活化分子的百分数增加 |
室温下,把1 mL 0.1 mol·L-1的H2SO4加水稀释成2 L溶液,在此溶液中由水电离产生的H+,其浓度接近于
| A.1×10-4 mol·L-1 | B.1×10-8 mol·L-1 |
| C.1×10-11 mol·L-1 | D.1×10-10 mol·L-1 |
一定温度下,在体积为10L的密闭容器中充满NH3,反应2NH3 3H2+N2经5s达到平衡,经测定NH3和H2的浓度均为amol/L,下列叙述中不正确的是
3H2+N2经5s达到平衡,经测定NH3和H2的浓度均为amol/L,下列叙述中不正确的是
| A.反应前后的压强比为5:7 | B.达到平衡时NH3的分解率为40% |
C.N2的平衡浓度为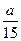 mol/(L·s) mol/(L·s) |
D.NH3在5s内的平均速度为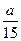 mol/(L·s) mol/(L·s) |