已知2A2(g)+B2(g) 2C3(g) △H=" -a" kJ•mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为w mol/L,放出热量b kJ;
2C3(g) △H=" -a" kJ•mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为w mol/L,放出热量b kJ;
(1)比较a __________b( 填>、=、<);
(2)若将反应温度升高到700℃,反应的平衡常数将_________(增大、减小或不变);
(3)能说明该反应已经达到平衡状态的是______
a.V(C3)=2V(B2); b.容器内压强保持不变
c.V逆(A2)=2V正(B2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_________
a.及时分离出C3气体; b.适当升高温度; c.增大B2的浓度; d.选择高效的催化剂
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) CH3OH(g); ΔH1
CH3OH(g); ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) +H2O(g);ΔH2
CH3OH(g) +H2O(g);ΔH2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为,此时的温度为(从上表中选择)。
(2)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
①该电池正极通入的物质为。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为;
②乙中总反应的离子方程式为;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为;
②乙中Fe电极是(填阳极或阴极),总反应式是,
电解一段时间后溶液PH将(填增大、减小或不变)
天然有机产物A是芳香族化合物,其中碳的质量分数是氧质量分数的2倍,完全燃烧后仅得到物质的量之比为2︰1的CO2和H2O。A具有极弱的酸性,且能与HI作用得到B,结构分子显示A分子内无相同官能团而B分子内对位有相同官能团,A分子内无氢键而B分子内有氢键。
已知 R–O–R′ +HI→R–O–H + R′–I
(1 ) A的化学式为
(2)写出A、B的结构简式(B中标出氢键),
(3)与A具有相同官能团的位置异构体有种(含自身)
与B具有相同官能团的位置异构体有种(含自身)
(4) A另有一种异构体C,无酸性,但能与NaOH以1︰3反应。
写出C与NaOH反应的化学方程式。
在沥青蒸气里含有多种稠环芳香烃,如下图所示A、B、C ……,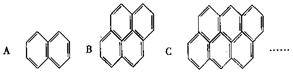
(1)该系列化合物的通式为,
(2)该系列化合物中碳的质量分数最大值为,
(3)其中A的二氯取代可能结构有种.
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系。回答下列问题:
(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子, Y原子的基态轨道表示式为,乙的电子式为。
(2) 若X基态原子外围电子排布式为3s1,甲是由两种短周期元素的原子构成的AB4型非极性分子,且是常见的有机溶剂,甲的电子式,乙的化学式为。
(3) 若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为:,Y原子基态电子排布式为。