我校某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
①在集气瓶中加少量的水,将水面上方的空间分为5等份.
②在带橡皮塞和导管的燃烧匙内装入一定量的红磷,将导管上的弹簧夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞.
③充分反应后,待集气瓶冷却至室温,打开弹簧夹.
请回答下列问题:
步骤②集气瓶中燃烧的主要现象是 ,其反应的文字表达式为 ;
步骤③中打开弹簧夹后观察到的现象是烧杯中的水沿着导管进入集气瓶的“1”处,由此可得出空气中氧气的体积约占 ;但本实验的结果是进入集气瓶中的水小于理论值,其原因可能是 ;
②中点燃红磷的方法有什么后果? _.

请仔细观察下图:
⑴ 把铝片放进硫酸铜溶液前,应进行的一个步骤是:,为什么要进行这个步骤;
⑵ 相同质量的铝和铜,哪种物质所含的原子的个数多;
⑶ 请写出铝片放入硫酸铜溶液的化学方程式 ;
⑷ 反应前后的烧杯中有什么离子是没有改变的,请写出该离子的符号;
⑸ 试从微观粒子变化的角度分析该反应的实质是:。
实验室开放日,某化学兴趣小组的同学在老师的指导下,进行了“自选仪器设计实验”的活动.实验室准备的仪器如下图所示: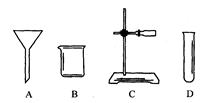
(1) 小凡同学一眼就认出仪器E是_________,G是___________。
(2) 小明同学利用上述仪器进行粗盐水的过滤,他选择了漏斗和铁架台,你认为他还需选择的仪器是____________、_______________(填名称)。
(3) 小强同学准备配制100g15.8%的食盐溶液,你认为还缺少的一种主要仪器是__。
已知在溶液中氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠。现实验室有一瓶失去标签但密封保存良好的白色粉末,可能是碳酸钠,也可能是氧化钙或氢氧化钙。为确定其组成,某同学设计了以下实验方案进行探究,请你按要求帮助完成探究活动。
(1)提出假设:假设①白色粉末是碳酸钠;假设②白色粉末是氧化钙;假设③白色粉
末是氢氧化钙。
| 设计的相关实验操作 |
实验中观察到的现象 |
假设是否成立 |
| 取一定量粉末加入稀盐酸 |
没有气体产生 |
假设① |
| 取一定量粉末溶于水 |
溶液浑浊且温度升高 |
假设② |
| 假设③ |
(2)设计实验,通过实验分析进行判断并填空:
根据假设②的现象写出对应的化学方程式________________________________;
(3)实验后思考:假定这包白色粉末是混有少量氧化钙的碳酸钠粉末,将混合物溶于水可观察到的现象是_____________________________________________________;若将反应后的混合物进行固液分离,分离的方法是________;再将分离后的溶液蒸干,得到的固体物质是________、__________(填化学式)。
| 假设是否成立 |
| 否 |
| 是 |
| 否 |
牙膏是最常用的日用化学品之一,牙膏的成分有活性物质、摩擦剂、保持牙膏湿润的甘油等物质。
【查阅资料】①牙膏摩擦剂的主要成分有CaCO3、Al(OH)3、SiO2。
②SiO2不溶于水,也不与酸反应。
③维生素C的水溶液pH小于7,显酸性。
某品牌牙膏含有上述摩擦剂中的两种成分,为探究摩擦剂的组成,化学兴趣小组取适量该牙膏加水充分搅拌、静置、过滤、洗涤、干燥,得到该牙膏中的摩擦剂。
【提出猜想】猜想1:摩擦剂的成分为Al(OH)3和CaCO3。
猜想2:摩擦剂的成分为_______________。
猜想3:摩擦剂的成分为SiO2和Al(OH)3。
【设计实验】
| 实验步骤 |
预期实验现象 |
预期实验结论 |
| 取少量摩擦剂于试管中,加入足量的稀盐酸 |
若摩擦剂________________________。 |
则猜想1成立 |
| 若摩擦剂部分溶解,不产生气泡。 |
则猜想___成立 |
【实验结论】猜想1成立。
【实验反思】
(1)氢氧化铝与盐酸反应的化学方程式为__。
(2)实验中选用稀盐酸而不选用稀硫酸的原因是_____________________________。
(3)根据实验结论,该品牌的牙膏中应该没有添加维生素C,理由是___________。
实验是学习化学的重要手段,通过实验可以培养实践能力和创新精神。
(一)实验室制取气体是初中一类重要的实验,结合下列仪器或装置图回答有关问题: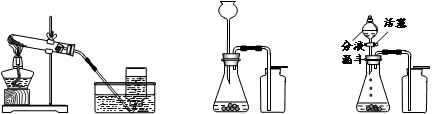
装置I装置Ⅱ装置Ⅲ
(1)装置I是用高锰酸钾制氧气,反应的化学方程式为_________________________,表明氧气已经收满的实验现象是。
(2)某同学用装置Ⅱ制取并收集二氧化碳,用燃着的木条放在集气瓶口验满,始终未发现火焰熄灭,原因是______________________________________________。
(3)用装置Ⅲ进行二氧化锰和双氧水制取氧气的实验时,若反应速率过快,可以采取的处理方法是。
(4)我们已经学过实验室制取O2、CO2、H2三种气体的反应原理及制取、收集方法。请你归纳出制取这三种气体时反应的共同点_______(填选项序号)。
| A.需要加热 | B.需使用催化剂 |
| C.没有气体参加反应 | D.生成的气体只有一种 |
(二)选用下列装置测定水的元素组成,请回答问题: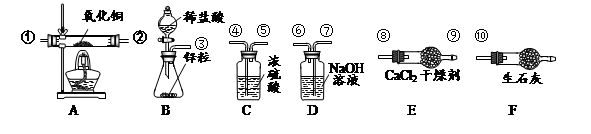
(5)为准确测定水的组成并防止杂质、空气等干扰,导管口的正确连接顺序为:
③→___→____→____→____→①→②→⑧→⑨→⑩。
(6)若测得A装置中样品在实验后减少了6.4克,E装置质量增加了7.2克,F装置增加了0.1克,据此可求出水中H、O元素质量比为(只写计算式)____________。
(7)实验结束后,若A处仍有黑色固体,这对实验结果的影响是________________(填“氧的质量偏大”、“氢的质量偏大”、“无影响”)。