我们学习了氧气的实验室制法,知道了制取气体的一般思路和方法.
实验室制取气体时,确定发生装置需要常考虑的两种因素是 .
| A.反应物的状态 | B.气体的密度 | C.反应的条件 | D.气体的溶解性 |
请根据下列装置图完成以下各题.

以高锰酸钾为原料制取氧气,应选用 和 装置来制取并
收集,反应的文字表达式是 ;
若用F装置收集气体,需满足的条件是 _;
A装置加热时,试管口略向下倾斜的原因是 .
同学们想探究双氧水的浓度对反应速率的影响.在其他条件相同的情况下进行
了三次实验,记录各收集一瓶相同体积氧气所需要的时间.
| 实验 |
30%双氧水的质量 |
加入的水的体积 |
二氧化锰质量 |
收集时间 |
| 1 |
10 |
40 |
5 |
200 |
| 2 |
20 |
30 |
5 |
100 |
| 3 |
30 |
20 |
|
67 |
取用二氧化锰的仪器是 ;

写出上述反应的文字表达式 ;
实验3中,加入的二氧化锰质量为 g;
相同条件下,实验3产生氧气的速率最快,说明反应与双氧水的 有关.
请回答下列问题: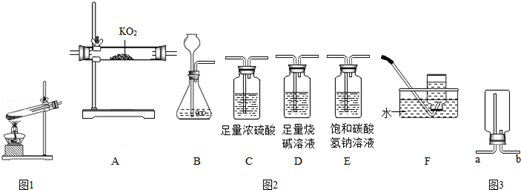
如图1是实验室中用加热氯酸钾和二氧化锰的混合物制取氧气的发生装置.请指出图中两处明显的错误:①;②.
某化学小组的同学查阅资料得知,超氧化钾
是一种固体,它能与二氧化碳反应生成氧气:
.此外,超氧化钾还能与水、氯化铵等物质发生反应.该小组同学决定用大理石和稀盐酸反应生成的二氧化碳与超氧化钾反应来制取氧气.实验中使用了如图2装置:
请回答下列问题:
①为了完成上述实验,各装置的连接顺序为(填序号).
②装置D的作用是.
③装置E的作用是.
④若用如图3装置收集制得的氧气,则气体应从 端(填a或b)进入.
小梅同学在家中与妈妈做面包,发现妈妈揉面粉时,在面粉中加入一种白色粉末﹣﹣发酵粉,蒸出来的面包疏松多孔.她很感兴趣想弄明白,发酵粉为什么能让蒸出来的面包疏松多孔呢?请你一同参与小梅的探究.
【提出问题】小梅要探究的问题是.
【查阅资料】发酵粉的主要成分是碳酸氢钠,俗称小苏打,易溶于水,其固体或溶液受热时均能分解,生成一种盐、一种气体和水.
【实验探究】小梅按下列实验方案探究小苏打受热分解的产物.
| 实验步骤 |
实验现象 |
实验结论 |
| 1.取适量小苏打固体于试管中加热,并将生成的气体通入澄清石灰水 |
(1)试管口处有液滴生成 (2)澄清石灰水变浑浊 |
(1)生成的液滴是水 (2)生成的气体是(写化学式) |
| 2.取少量充分加热后的剩余固体溶于水并加入稀盐酸 |
生成的盐是碳酸钠 |
【实验结论】小苏打受热分解产生的气体在面团中形成许多小气室,使蒸出来的面包疏松多孔.那么小苏打受热分解的化学方程式是.
【拓展延伸】小玲查阅资料发现:①
;②氢氧化钙微溶于水.小玲把
溶液与
溶液混合后却无明显现象,她产生疑问:这两种物质是否发生了化学反应?在老师帮助下,它们分别通过以下2个实验证明
溶液与
溶液的确发生了反应(方案1和方案2的实验过程没标出).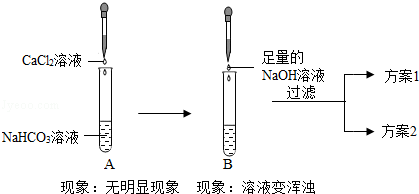
【实验1】证明反应生成了
.
小玲认为当B中溶液变浑浊,就能证明有
生成,细心的小梅认为该结论不对,其理由是.小梅接着上图中实验,又设计了方案1来证明反应后生成了
.那么方案1是(要求写出实验步骤、现象和结论).
【实验2】,证明反应后
不存在.
小明接着上图中实验,又设计了方案2来证明反应后
不存在.那么方案2是(要求写出实验步骤、现象和结论).
【总结归纳】通过实验1和实验2说明.对于没有明显现象的化学反应,可以从两个不同角度证明反应的发生.这两个角度是:一是,二是.
化学是一门以实验为基础的科学.下图是实验室制取气体的部分装置,请结合所学化学知识,回答下列问题:
(1)写出图中标有字母的仪器名称:a.
(2)实验室用B装置来制取氧气的化学方程式是;若用D装置来收集氧气,验满的方法是:将一根带火星的木条伸到集气瓶口,如果,证明已收集满氧气.
(3)实验室常用氯化铵固体与碱石灰固体共热来制取氨气.已知常温下氨气是一种无色、密度比空气小的气体.氨气极易溶于水,其水溶液呈碱性.如果实验室要制取并收集一瓶氨气,应该选择的装置是(填序号).氨气是一种碱性气体,干燥时不能选用下列干燥剂中的(填序号).
| A. |
固体氢氧化钠 |
B. |
浓硫酸 |
C. |
生石灰 |
实验室部分仪器或装置如图所示,请回答下列问题.
(1)实验室常用石灰石和稀盐酸制取二氧化碳气体,发生装置可选择图中的(填仪器字母)进行组装,反应的化学方程式为。
(2)在制取过程中,小雨同学选用
装置收集二氧化碳,并用燃着的小木条放在瓶口验证二氧化碳是否收集满,结果发现小木条始终不灭,说明该瓶气体没有集满.出现上述情况的原因可能是1,2,3(写出其中3条).
(3)采用上述方法制取的二氧化碳中常含有氯化氢气体和水蒸气.为获得纯净、干燥的二氧化碳气体,可选用图所示的
装置和
装置进行除杂和干燥,导管口连接的正确顺序是:气体→→
.
(4)在实验室中制取氢气,发生装置与制二氧化碳的相同,收集方法可采用(填"向上"或"向下")排空气法.若用如图
所示装置采用"排空气法"收集氢气,请在图中将导管补画完整.
某化学兴趣小组设计了如图所示的装置,对纯碱(
)和小苏打(
)两种固体进行实验探究.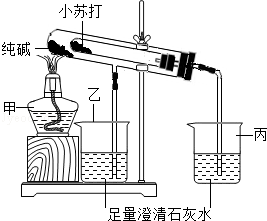
(1)写出甲、丙两种仪器的名称:甲,乙.
(2)在实验过程中,观察到乙仪器中的澄清石灰水变浑浊,请写出丙仪器中发生反应的化学方程式.
(3)该实验探究利用的科学方法是(填"控制变量法"、"对比观察法"或"定量分析法"),实验目的是.