将24g由木炭和氧化铜组成的混合物充分加热,其中木炭完全反应,反应结束后将剩余物冷却, 称得固体质量为19.6g,请计算:
(1)生成二氧化碳 。
(2)生成单质铜多少克?
波尔多液是一种农业上常用的杀虫剂,它由硫酸铜、生石灰加水配制而成。
(1)硫酸铜所含阴离子的符号是。生石灰加水过程中会(填"放"或"吸")热。
(2)煅烧石灰石(主要成分
)可制得生石灰(
)。若要制取
氧化钙,根据化学方程式计算需要碳酸钙的质量是多少?
(3)波尔多液不能用铁质容器来配制的原因是.
为测定某氮肥中硫酸铵的纯度(及质量分数)是否与下图标签相符合,小林取15g该氮肥样品配成溶液,加入足量氯化钡溶液充分反应后,过滤、洗涤、烘干,测得沉淀质量为23.3g。试通过计算确定该氮肥中硫酸铵的纯度是否与标签相符。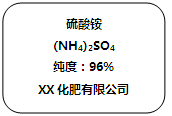
【反应的化学方程式为
,其他成分能溶于水但不参加反应】
马英同学取某地石灰石样品
进行测定实验,现将
稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:
| 第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
|
| 加入稀盐酸的质量 | |||||
| 生成气体的总质量
|
试求:
(1)
的值为
(2) 石灰石样品中碳酸钙的质量等于
(3)反应完全后最终溶液中氯化钙的质量分数?(写出计算过程,计算结果精确至0.1)
实验室常用石灰石和稀盐酸制取二氧化碳,现取含碳酸钙80%的石灰石12.5
和94.4
稀盐酸恰好完全反应(石灰石中的杂质不溶于水,也不与稀盐酸反应)。求:
(1)生成二氧化碳的质量;
(2)恰好完全反应后所得溶液中溶质的质量分数。
某同学为了测定铜镁合金样品中铜的质量分数,将100
稀盐酸分2次加入到盛有5
该样品的烧杯中,所得数据如下表,则下列说法中错误的是
| 次数 |
实验前 |
第1次 |
第2次 |
| 加入稀盐酸的质量/ | 0 |
50 |
50 |
| 剩余固体的质量/ | 5 |
3 |
2 |
| A. |
第1次加入稀盐酸后剩余固体中还有镁 |
B. |
第2次所加入的稀盐酸未反应完 |
C. |
每50 稀盐酸和1 镁恰好完全反应 |
D. |
合金样品中铜的质量分数为40% |