下列反应过程能量变化如下所示:
H2(g) + Cl2(g) = 2HCl(g) ΔH

下列说法错误的是
| A.H—H键比Cl—Cl键稳定 |
| B.ΔH=" —" 184.5 kJ·mol-1 |
| C.正反应活化能比逆反应活化能高 |
| D.在相同条件下,1mol H2(g)和1mol Cl2(g)分别在点燃和光照条件下反应生成2mol HCl(g),重新恢复到原来的状态时ΔH相同 |
下列有关技术手段或仪器在化学研究中的应用的说法不正确的是 ( )。
| A.用电子天平可直接称出某个分子或原子的质量 |
| B.用pH计测定溶液的pH |
| C.用移液管量取25.00 mL溶液 |
| D.用量热计测定某些化学反应的反应热 |
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是 ()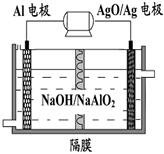
A.该隔膜是阳离子交换膜 |
| B.正极的电极反应式为:O2+2H2O+4e-=4OH- |
| C.负电极的反应式为:Al-3e-= Al3+ +2H2O |
| D.当电极上析出5.4 g Ag时,电路中转移的电子为0.1mol |
咖啡酸(X)可用作化学原料和中间体,其结构如图,X和Y(1,4-环己二酮单乙二醇缩酮)为原料合成药物Z可用于治疗哮喘、系统性红斑狼疮等,如下图。下列说法正确的是( )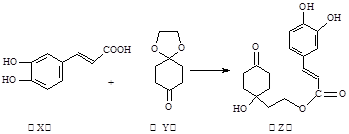
| A.Z的分子式为C17H22O6 |
| B.Y、Z中均含1个手性碳原子 |
| C.Z能发生加成反应、取代反应及消去反应 |
| D.1mol Z至多可与3mol Br2发生反应 |
硫酸的产量是衡量一个国家化工水平的标志。2SO2(g) + O2(g)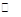 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
| 甲 |
乙 |
丙 |
||
| 起始物质的量 |
n(SO2) / mol |
0.4 |
0.4 |
0.8 |
| n(O2) / mol |
0.24 |
0.48 |
0.48 |
|
| SO2的平衡转化率 |
80% |
α1 |
α2 |
|
下列判断中,正确的是( )
A.甲中反应的平衡常数大于乙 B.平衡时,SO2的转化率:α1<80%<α2
C.该温度下,乙中平衡常数值为400 D.平衡时,丙中c(SO3)是甲中的2倍
下列表示对应化学反应的离子方程式正确的是( )
A.Na2CO3溶液的水解:CO32—+H3O+ HCO3—+H2O HCO3—+H2O |
| B.向偏铝酸钠溶液中通入过量二氧化碳气体:AlO2-+ CO2+2H2O = Al(OH)3↓+ HCO3— |
| C.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
| D.向碳酸氢钙溶液中加入少量NaOH溶液:Ca2+ +2HCO3— +2OH- =CaCO3↓+CO32-+2H2O |