下列离子方程式与所述事实相符且正确的是
| A.在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:Mn2++C1O-+H2O=MnO2↓+C1-+2H+ |
| B.用稀硝酸清洗做过银镜反应的试管:Ag+NO3-+4H+=Ag++NO↑2H2O |
| C.向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4C1- |
D.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:2C1-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
利用右图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
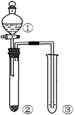 |
| A |
浓硫酸 |
Cu |
KMnO4溶液褪色 |
SO2有漂白性 |
|
| B |
浓盐酸 |
MnO2 |
FeBr2溶液变为黄色 |
氧化性:Cl2 >Br2 |
|
| C |
稀硫酸 |
碳酸钠 |
CaCl2溶液无明显变化 |
CO2不与CaCl2溶液反应 |
|
| D |
浓硫酸 |
蔗糖 |
溴水褪色 |
浓硫酸具有脱水性、吸水性 |
由右表提供数据及相关物质结构知识,反应:SiCl4(g)+2H2(g)→Si(s)+4HCl(g),生成1mol
晶体硅的热效应是
| 化学键 |
Si-Cl |
H-H |
Si-Si |
H-Cl |
| 键能(kJ/mol) |
360 |
436 |
176 |
431 |
A.吸收236kJ B.放出236kJ C.放出116kJ D.吸收116kJ
工业上常用如下的方法从海水中提溴: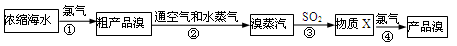
下列说法错误的是
| A.步骤①的主要反应为:Cl2+2Br–→Br2+2Cl– |
| B.物质X为HBrO |
| C.步骤②③的目的是富集溴元素 |
| D.步骤②利用了溴易挥发的性质 |
向0.1 mol / L CH3COOH溶液中加入CH3COONa晶体或加水稀释时,都会引起
| A.溶液的pH增大 | B.CH3COOH的电离程度增大 |
| C.溶液的导电能力减小 | D.溶液的c(OH-)减小 |
用右图装置研究电化学原理,下列分析中错误的是
| 选项 |
连接 |
电极材料 |
分析 |
|
| a |
b |
|||
| A |
K1 K2 |
石墨 |
铁 |
模拟铁的吸氧腐蚀 |
| B |
K1 K2 |
锌 |
铁 |
模拟钢铁防护中牺牲阳极的阴极保护法 |
| C |
K1 K3 |
石墨 |
铁 |
模拟电解饱和食盐水 |
| D |
K1 K3 |
铁 |
石墨 |
模拟钢铁防护中外加电流的阴极保护法 |