用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是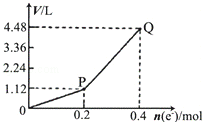
| A.电解过程中,溶液的pH不断增大 |
| B.Q点对应的气体中,H2与O2的体积比为2:1 |
| C.阳极电极反应式为2H2O+4e﹣=4H++O2↑ |
| D.当转移0.4mol e﹣时,电解生成的铜为6.4g |
下列物质中σ键和π键数目比为1 :2的是( )
| A.O2 | B.HCN | C.CO2 | D.N2 |
下列基态原子或离子核外未成对电子数目为5的是 ( )
| A.Fe3+ | B.P | C.Cr | D.Cu |
下列有关能源与能量的说法正确的是( )
| A.煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源 |
| B.蒸汽属于一次能源 |
| C.凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应 |
| D.反应物和生成物的总能量决定反应是放热还是吸热 |
下列各表述与示意图一致的是( )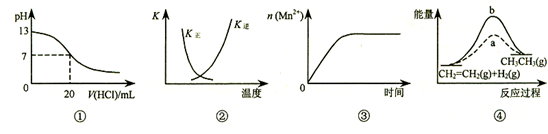
A.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| B.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 |
在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g) 2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下: 
下列说法不正确的是()
| A.容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol·L-1·min-1 |
| B.2c1<1.5 |
C.在该温度下甲容器中反应的平衡常数K= |
| D.2ρ1=ρ2 |