在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法中正确的是
| A.100 ℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液等体积混合时恰好中和,所得溶液的pH等于7 |
| B.25 ℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl溶液等体积混合,所得溶液的pH等于7 |
| C.25 ℃时,0.2 mol/L NaOH溶液与0.2 mol/L醋酸等体积混合后恰好中和,所得溶液pH等于7 |
| D.25 ℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7 |
下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
下列有关说法中不正确的是 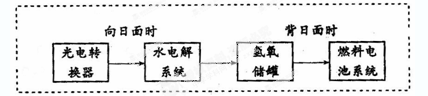
| A.该能量转化系统中的水也是可以循环的 |
| B.燃料电池系统产生的能量实际上来自于水 |
| C.水电解系统中的阳极反应:4OH-―4e-=2H2O+O2↑ |
| D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O |
今有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不氧化Fe2+和Cl-,则可加入的试剂是
| A.Cl2 | B.KMnO4 | C.HCl | D.FeCl3 |
用石墨做电极电解足量CuSO4溶液。通电一段时间后,欲使用电解液恢复到初始状态,可向溶液中加入适量的
| A.CuSO4 | B.CuO |
| C.H2O | D.CuSO4·5H2O |
要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂。
已知Pb2+与这些离子形成的化合物的溶解度如下表:
| 化合物 |
PbSO4 |
PbCO3 |
PbS |
| 溶解度/g |
1.03×10-4 |
1.81×10-7 |
1.84×10-14 |
由上述数据可知,选用的沉淀剂最好为
A.硫酸盐B.碳酸盐
C.硫化物D.任何一种即可
双氧水可作为采矿业废液的处理剂,如用来消除采矿废液中的氰化物,反应方程式如下:KCN+H2O2+H2O===A+NH3↑。下列说法正确的是
| A.生成物A是一种正盐 | B.氨气是还原产物 |
| C.该反应中H2O2作氧化剂 | D.处理1 mol KCN转移1 mol电子 |