如图甲池和乙池中的四个电极都是铂电极,乙池溶液分层,上层溶液为某盐溶液,呈中性。请根据下图所示,判断下列有关说法正确的是
| A.甲池是电解池,乙池是原电池;A电极反应式为:C2H5OH+3H2O -12e-===2CO2+12H+ |
| B.反应一段时间后,两池溶液的pH均未变化 |
| C.假如乙池中加入K2SO4溶液,隔膜只允许K+通过,当电路中转移0.01mol e-时,则隔膜左侧溶液中最终减少离子约0.02mol |
| D.假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色 |
下列有关反应限度的说法错误的是
| A.某条件下可逆反应达到限度之前,逆反应速率逐渐增大可能与生成物浓度逐渐增大有关 |
| B.炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度 |
| C.化学反应的限度决定了反应物在该条件下的最大转化率 |
| D.可逆反应的限度不随反应条件的改变而改变 |
对于反应2SO2+O2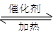 2SO3下列判断正确的是
2SO3下列判断正确的是
| A.2 mol SO2和足量的O2反应,必生成2 mol SO3 |
| B.平衡时SO2、O2、SO3的分子数之比为2∶1∶2 |
| C.平衡时SO2的消耗速率必定等于O2的生成速率的2倍 |
| D.平衡时SO2的浓度必为O2浓度的2倍 |
决定化学反应速率的根本因素是
| A.温度和压强 | B.反应物的浓度 |
| C.物质自身的性质 | D.催化剂的加入 |
下列反应既是氧化还原反应,又是吸热反应的是
| A.锌粒与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的碳与CO2反应 | D.葡萄糖在人体内氧化 |
下列离子在溶液中因发生氧化还原反应而不能大量共存的是
| A.H+、NO3—、Fe2+、Na+ | B.Ag+、NO3—、C1—、K+ |
| C.K+、Ba2+、OH—、SO42— | D.Cu2+、NH4+、Br—、OH— |