工业上回收利用某合金废料(主要含Fe、Cu、Al、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:

已知:Ksp[Cu(OH)2]=4.0×10-21,Ksp[Al(OH)3]=1.0×10-32,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=8.0×10-19。pH=7.3时Li+或Co3+开始沉淀。
(1)金属M为 。
(2)①加入H2O2的作用是(用离子方程式表示) 。
②氨水的作用是调节溶液的pH,室温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol·L-1) 。需调节溶液pH范围为 。
(3)充分焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是 。
| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
(6)①用Li、Co形成某锂离子电池的正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图a)。电池反应为LixC6+Li1-xCoO2 C6+LiCoO2,
C6+LiCoO2,
写出该电池放电时的负极反应式___________________________。
②锂硫电池的总反应为:2Li+S Li2S,图b表示用锂离子电池给锂硫电池充电,请在图b的电极( )中填写“Li”或“S”,以达到给锂硫电池充电的目的。
Li2S,图b表示用锂离子电池给锂硫电池充电,请在图b的电极( )中填写“Li”或“S”,以达到给锂硫电池充电的目的。


已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6。M与其他物质的转化关系如下(部分产物已略去):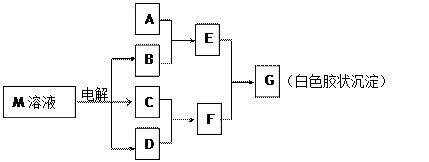
(1)若A是与X、Y同周期的一种常见金属,则A元素在周期表中的位置是周期
族,写出A与B溶液反应的化学方程式。
(2)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示
意图为,写出E与F反应的离子方程式。
(3)B的电子式为__________,其中的化学键为______________。
用电子式表示M的形成过程。
(4)工业上用电解物质M的产物之一氧化有毒含氰(CN—)碱性废水,得到无毒的N2、CO2等。写出此反应的离子反应方程式。
双酚A(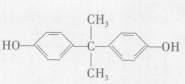 )可用于制造多种高分子材料。现有如下转化关系。
)可用于制造多种高分子材料。现有如下转化关系。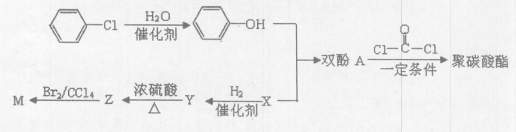
已知:
请回答:
(1)双酚A中含氧官能团名称为。
(2)有机物Y中含碳的质量分数为60%,含氧的质量分数是氢质量分数的2倍,质谱表明其相对分子质量为60,核磁共振氢谱中显示有3种峰,则Y的结构简式为。
(3)写出Y→Z的化学方程式:。
(4)下列说法中正确的是(填序号)。
①双酚A的分子式为C9H14O2
②双酚A最多能与2molBr2发生苯环上的取代反应
③M的同分异构体(含M)共有4种
④Y能发生消去反应、取代反应、氧化反应
(5)写出由苯酚与x反应制取双酚A的化学方程式:。
(6)由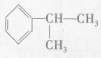 可以得到制取双酚A的原料,该有机物含苯环的同分异构体还有
可以得到制取双酚A的原料,该有机物含苯环的同分异构体还有
种,写出其中苯环上只有一种氢的同分异构体的结构简式:。
(7)写出由双酚A制取聚碳酸酯的化学方程式:。
煤的直接燃烧已引起严重的生态和环境污染,并且其直接燃烧很难解决温室气体减排问题。解决煤炭的清洁高效利用问题是中国发展低碳经济的关键。下图是煤气化和除硫的实验系统示意图: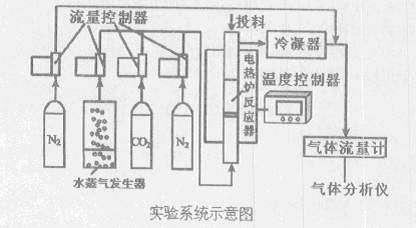
其操作步骤为:
I.升温至实验温度,通人高纯N2,从投料口加人石英砂(含载氧体)
Ⅱ.停止通入N2,从反应器下方按比例通入水蒸气和CO2,从投料口加入CaO
Ⅲ.停止通入水蒸气和CO2,从投料口加入煤
Ⅳ.持续通入水蒸气和CO2,开始反应;在气体出口管中通人高纯N2
(1)冷凝器的作用是。
(2)可使用CaCO3代替CaO脱硫,CaCO3脱硫的化学方程式为。
(3)通人N2的目的:。
(4)反应器中发生如下几种反应:
C(s)十H2O(g)=CO(g)+H2(g)△H=+131kJ/mol
C(s)+O2(g)=CO2(g)△H=-394kJ/mol
CO(g)+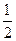 O2(g)=CO2(g)△H=-283kJ/mol
O2(g)=CO2(g)△H=-283kJ/mol
CO(g)+H2O(g)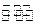 H2(g)+CO2(g)
H2(g)+CO2(g)
下图能表示CO与H2O(g)生成CO2和H2的反应过程和能量关系的图是(填序号)。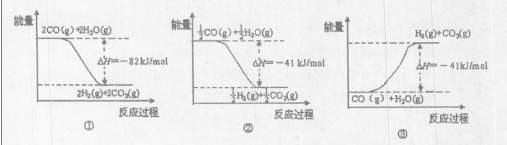
(5)已知830℃时,CO(g)+H2O(g)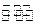 H2(g)+CO2(g)的平衡常数K=1,等物质的量的CO和H2O反应达到平衡时,CO的转化率为.
H2(g)+CO2(g)的平衡常数K=1,等物质的量的CO和H2O反应达到平衡时,CO的转化率为.
(6)煤气化过程中会生成少量CH4,已知CH4与CaSO4反应生成CaS、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为。
(7)煤气化后,混合气体由CO、H2和CH4等组成,可用于制燃料电池。其中碱性条件下CH4参与反应的电极反应式为。
镁砂(MgO)是一种高温耐火材料。下图是氨法制取高纯镁砂的部分工艺流程: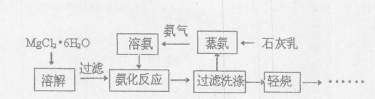
请回答:
(1)MgCl2·6H2O溶于水,溶液呈(填“酸性”、“中性”或“碱性”)。
(2)写出氨气的电子式。
(3)蒸氨是将石灰乳通人氯化铵溶液中并加热,写出该反应的化学方程式:。
(4)轻烧后的产物为。
(5)过滤洗涤主要是除去附着在固体表面的氯离子,检验沉淀已洗涤干净的方法是。
(6)氨化反应过程中反应的离子方程式为。
(7)已知向Mg(OH)2沉淀中滴加氯化铵溶液可观察到沉淀溶解,该实验应注意使用饱和氯化铵溶液、边滴加边振荡,试解释该反应发生的原理(用离子方程式表示和文字说明)。
(4分)A、B、C、D四种气体,都是大气的污染物。国家环境保护法严格禁止把这类气体大量排入空气中,工业上通常都用碱液加以吸收。已知A的水溶液是一种无氧酸,A在空气中充分燃烧得到B;B是形成酸雨的主要污染物;C是一种单质,其水溶液具有漂白作用;D是硝酸工业尾气中有害物质之一,易溶于水。根据推断结果和下列要求写出有关的化学方程式。
(1) A在空气中完全燃烧:。
(2) B的水溶液被空气氧化:。
(3) C跟消石灰反应:。
(4) D跟水反应:。