LiFePO4电池具有稳定性高、安全、对环境友好等优点。某电极的工作原理如左下图所示,该电池电解质为能传导 Li+的固体材料。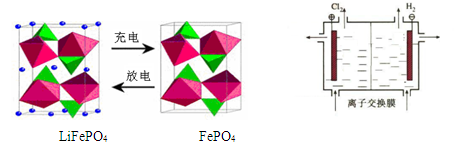
(1) 放电时,该电极为_____极,电极反应为__________________________
(2) 充电时该电极连接外接电源的______极
(3) 放电时,电池负极的质量_______(减少、增加、不变)
(4) LiOH可做制备锂离子电池电极的材料,利用如右上图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。阴极区电解液为__________溶液(填化学式),离子交换膜应使用__________(阳、阴)离子交换膜。
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1mol•L‾1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O, 250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H= kJ·mol‾1。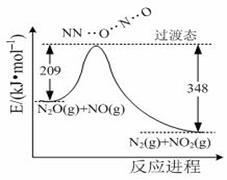
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为 。
(2)与OH-互为等电子体的一种分子为 (填化学式)。
(3)醛基中碳原子的轨道杂化类型是 ;1mol乙醛分子中含有的σ键的数目为 。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为 。
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为 。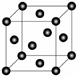
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为__色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
(14分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式: 。
(2)LiFePO4是一种新型动力锂电池的电极材料。
①下图为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式: 。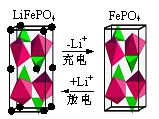
②将LiOH、FePO4·2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4。焙烧过程中N2的作用是 ;实验室中以Fe3+为原料制得的FePO4·2H2O有时显红褐色,FePO4·2H2O中混有的杂质可能为 。
(3)磷及部分重要化合物的相互转化如图所示。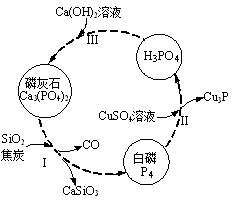
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1molCuSO4所能氧化的白磷的物质的量为 。
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 。
2014年8月3日16时30分在云南省昭通市鲁甸县(北纬27.1度,东经103.3度)发生6.5级地震,震源深度12千米,已致589人遇难。饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
| 阳离子 |
K+、Na+、Cu2+、Al3+ |
| 阴离子 |
SO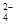 、HCO 、HCO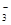 、NO 、NO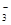 、OH- 、OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验现象填写下列空白:
(1)写出化学式:A________ 、B________、C ________ 、D________。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为________。
(3)写出实验②发生反应的离子方程式__________________、________________。
(4)C常用作净水剂,用离子方程式表示其净水原理_________________________。