(1)下列有关硅单质及其化合物的说法正确的是 。
A.高纯度的硅单质广泛用于制作光导纤维
B.水泥、玻璃、陶瓷都是硅酸盐产品
C.自然界中的硅元素储量丰富,并存在大量的硅单质
D.SiO2属于酸性氧化物,故只与碱溶液发生化学反应,不与任何酸反应
(2)某些化学反应可用下式表示(未配平):A+B→C+D+H2O,请回答下列问题:
①若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,D具漂白性。
A. 写出该反应的离子方程式: 。
B. Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaClO3=Mg(ClO3)2+2NaCl
MgCl2+2NaClO3=Mg(ClO3)2+2NaCl ,已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
,已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:



将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
②若A与B加热生成的产物C、D均为无色气体,且C、D两分子中组成元素的原子个数比都为1:2,则符合上式的化学方程式是: 。
③若A为过氧化钠,B为硫酸,则C、D的化学式为 、 。
22. 某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
(1)混合物中是否存在FeCl2:____________(填“是”或“否”)。
(2)混合物中是否存在(NH4)2SO4:____________(填“是”或“否”)。
(3)写出反应⑤的离子方程式:________________________。
(4)请根据图中数据分析,原固体混合物的成分为(写化学式)
Na2CO3和H2O2结合成棒状晶体,Na2CO3·xH2O2(过氧化氢合相当于水合。注意:使用高浓度H2O2时一定要小心,防止爆炸生成水和氧气),可消毒、漂白或作O2源…。
现称取一定质量的Na2CO3·xH2O2晶体加热。实验结果以温度和相对质量分数示于下图。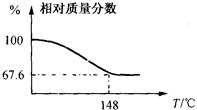
(1)该棒状晶体的化学式Na2CO3·xH2O2中x=。
(2)加热过程中,在141℃时表现为放热,其原因可能是:
a. Na2CO3·xH2O2分解放热
b.产生的H2O2分解放热
c. Na2CO3·xH2O2分解吸收热量小于产生的H2O2分解放出的热量
(3)事实上,Na2CO3·H2O2(x=1时)是Na2CO4·H2O(Na2CO4叫做过氧碳酸钠)。洗衣粉中加入适 量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒。试用化学方程式表示上述洗涤原理:。
量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒。试用化学方程式表示上述洗涤原理:。
(4)写出Na2CO4溶液与稀硫酸反应的离子方程式。
(5)下列物质不会使过碳酸钠失效的是
| A.MnO2 | B.H2S | C.CH3COOH | D.NaHCO3 |
(6) Na2O2、K2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢的水溶液可通过上述某种过氧化物与适量稀硫酸作用,最适合的过氧化物是,原因是。要使获得的过氧化氢从其水溶液中分离出来,采取的措施是 。
。
.下表是某食用碘盐包装袋上的部分说明:
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量 |
35±15mg/kg |
| 储藏方法 |
密封、避光、防潮 |
| 食用方法 |
烹饪时,待食品熟后加入碘盐 |
请回答下列问题:
(1)下列说法正确的是。
A.碘酸钾易挥发 B.高温会导致碘的损失
C.用淀粉就能直接检验碘盐中的碘酸钾 D.碘酸钾可氧化氯化钠
(2)碘酸钾与碘化钾在酸性条件下发生如下反应:KIO3+KI+H2SO4→K2SO4+I2+H2O(未配平),该化学方程式配平后系数依次为。
w.该反应的还原剂为;1mol KIO3完全反应转移的电子总数为。
(3)碘不能多也不能少。已知:I2+2S2O32-=2I-+S4O62-,我校化学兴趣小组测定某食用碘盐中碘的含量。其步骤为:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;③以淀粉为指示剂,逐滴加入物质的量浓度为1.0×11-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示)mg/kg。
A-H及X均为中学化学常见物质, X是一种金属单质,A、B是非金属单质且A在常温下为气体。它们在一定条件下有如下转化关系(图中条件均已略去)。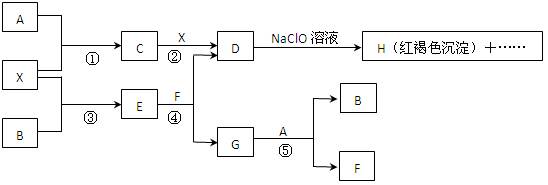
试回答下列问题:
(1)写出C物质的化学式 ;
(2)在上述①-⑤ 反应中肯定不属于氧化还原反应的是 (填编号);
反应中肯定不属于氧化还原反应的是 (填编号);
(3)指出元素X在元素周期表中的位置: ;
(4)请写出反应④和⑤的离子方程式:④ ,
⑤ ;
(5)用离子方程式表示在D溶液中加入NaClO溶液产生红褐色沉淀的原因:
。
现有物质A~I,其转化关系如下图,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(部分反应条件及生成的其它物质已略去)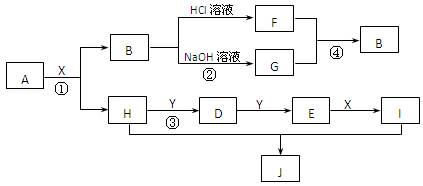
根据上述转化关系图回答:
(1)写出下列物质的化学式 X;J
(2)物质H的电子式:;
物质J属于哪种晶体类型: 。
。
(3)写出反应①的化学方程式;
写出反应④的离子方程式。