二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。

(1)如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装
置是 (填写字母),e装置中的导管作用为 。
(2)工业上制备Na2S2O3反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,某研究小组在实验室制备Na2S2O3·5H2O流程如下:
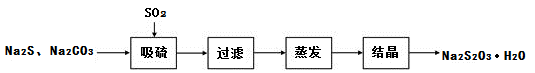
吸硫装置如图所示:
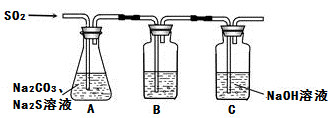
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 。
③用双线桥表示下面化学反应的电子转移方向和数目:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。
④Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取0.214g KIO3固体配成溶液,加入过量KI固体和H2SO4溶液,再向其中加入Na2S2O3与之反应,消耗Na2S2O3 溶液的体积为24mL时恰好完全反应。则c(Na2S2O3)= 。
(已知:IO3-+5I-+6H+=3I2+3H2O 2S2O32-+I2=S4O62-+2I-)
在试管A中加入3 mL 乙醇,然后边振荡试管边慢慢加入2 mL 浓硫酸和2 mL 乙酸,按下图所示连接好装置制取乙酸乙酯。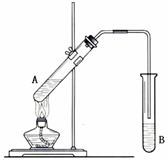
(1)试管B中盛放的溶液是,
其作用是:_________________________
导管末端不能插入试管B溶液液面以下的原因______________________________________________
(2)乙醇与乙酸反应的化学方程式是:_________________________
(3)实验完成后,试管B内液体分为两层,其中无色透明油状液体位于 __________层(填“上”或“下”)。若分离B中的液体混合物需要用到的玻璃仪器主要是。
我国制碱工业的先驱 侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓(晶体)
侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓(晶体)
依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。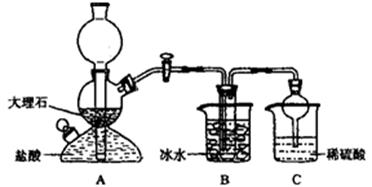
(1)A装置中所发生反应的离子方程式为________。C装置中稀硫酸的作用为_________。
(2)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在装置之间(填写字母)连接一个盛有的洗气装置,其作用是。
(3)过滤NaHCO3时除烧杯、漏斗外,还用到另一玻璃仪器,该仪器在此操作中的主要作用是。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的晶体的质量为5.04g,则NaHCO3的产率为。
(12分)实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算③溶解 ④摇匀 ⑤转移
⑥洗涤⑦定容 ⑧冷却 ⑨振荡
其正确的操作顺序为______________。本实验必须用到的仪器有托盘天平、药匙、玻璃棒、烧杯、____________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为______g,要完成本实验该同学应称出______g NaOH。
(3)使用容量瓶前必须进行的一步操作是______。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是______。
| A.转移溶液时不慎有少量洒到容量瓶外面 |
| B.定容时俯视刻度线 |
| C.未冷却到室温就将溶液转移到容量瓶并定容 |
| D.定容后塞上瓶塞反复倒转摇匀,静置后,液面低于刻度线,再加水至刻度线 |
某学习小组研究同周期元素性质递变规律时,设计并进行了下列实验(表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ② 向新制得的Na2S溶液中滴加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
| ③ 将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体 |
| ④ 将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
| ⑤ 将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥ 向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉淀。 |
(1)请将各实验步骤对应的实验现象填写入下表中:
| 实验步骤 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A~F) |
C |
D |
(2)此实验可得出的结论是:
Na、Mg、Al金属性强弱关系:,Cl、S非金属性强弱关系:。
(14分)4,7—二甲基香豆素(熔点:132.6℃)是一种重要的香料,广泛分布于植物界中,由间—甲苯酚为原料的合成反应如下:
实验装置图如下:
主要实验步骤:
步骤1:向装置a中加入60mL浓硫酸,并冷却至0℃以下,搅拌下滴入间—甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物。
步骤2:保持在10℃下,搅拌12h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品
步骤3:粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0g。
(1)简述装置b中将活塞上下部分连通的目的。
(2)浓H2SO4需要冷却至0℃以下的原因是。
(3)反应需要搅拌12h,其原因是。
(4)本次实验产率为(百分数保留一位小数)
(5)实验室制备乙酸乙酯的化学反应方程式,用(填药品名称)收集粗产品,用(填操作名称)的方法把粗产品分离。