酸牛奶是人们喜爱的一种营养饮料。酸牛奶中有乳酸菌可产生乳酸等有机酸,使酸碱度降低,有效地抑制肠道内病菌的繁殖。酸牛奶中的乳酸可增进食欲,促进胃液分泌,增强肠胃的消化功能,对人体具有长寿和保健作用,乳酸的结构为: 。工业上它可由乙烯来合成,方法如下:
。工业上它可由乙烯来合成,方法如下:
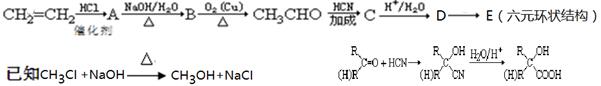
(1)D的结构简式 ,所含的官能团的名称是 。
(2)写出下列转化的化学方程式:
①A的生成 。
②C的生成 。
③B的生成 。
④D→E 。
【化学——选修5:有机化学基础】已知:苯和卤代烃在催化剂作用下可以生成烷基苯和卤化氢。根据以下转化关系(生成物中所有无机物均已略去),回答下列问题: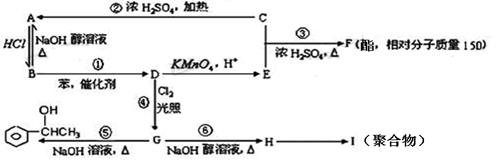
(1)H中所含官能团的名称是 ,E中所含官能团的结构式是 ,D的结构简式为 。
(2)①②③④⑤⑥反应中属于消去反应的是 。
(3)写出反应⑥的化学方程式 。写出H→I的化学方程式______________________________。
(4)写出符合下列要求的F的同分异构体的结构简式:
① F的同分异构体中属于酯类,能发生银镜反应,苯环上有两个取代基且苯环上的一氯代物只有两种: 。
② F的同分异构体中属于醇类,能发生银镜反应,苯环上有两个取代基且苯环上的一氯代物只有两种: 。(写出一种即可)
【选修5:有机化学基础】某有机物A的水溶液显酸性,遇FeCl3溶液不显色,A分子结构中不含甲基,含苯环,苯环上的一氯代物只有两种,G的分子式为C7H6O3,A和其他有机物存在如下图所示的转化关系: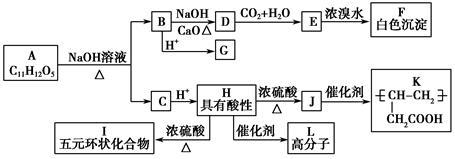
已知: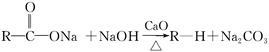
试回答下列问题:
(1)B化学式_________________________________,
(2)H→I反应类型为__________________________,
J所含官能团的名称为_______________________________。
(3)写出H→L反应的化学方程式_________________________________。
(4)A的结构简式____________________________________。
(5)F的同分异构体中含有苯环且官能团相同的物质共有_________种(不包括F),其中核磁共振氢谱有两个峰,且峰面积比为1∶2的是_________(写结构简式)。
下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。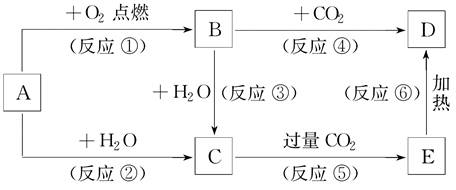
填写下列空白:
(1)写出化学式:A________,B_________,D_________E_______。
(2)以上反应中不属于氧化还原反应的有______________(填序号)。
(3)写出反应②④⑥的化学方程式:
②_______________________________。
④_______________________________。
⑥_______________________________。
(4)写出反应⑤的离子方程式:_____________________,写出铝粉和C溶液反应的离子方程式:___________________
下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题:
| IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 1 |
① |
|||||||
| 2 |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
||
| 3 |
⑧ |
⑨ |
⑩ |
(1)自然界物质种类最多的元素在周期表中的位置是_____________________
(2)⑧⑨⑩的离子半径由大到小的顺序为 (填化学用语)。
(3)写出由⑥、⑧、⑩元素形成的一种离子化合物的电子式_____________________
(4)②的最高价氧化物对应的水化物与盐酸反应的离子方程式____________________
(5)根据斜线性质相似规则,③的氧化物,氢氧化物有两性,写出③的单质与⑧的最高价氧化物的水化物反应的化学方程式___________________________
(6)已知W+X=Y+Z,W、X、Y、Z分别是由①⑤⑥三种元素形成的四种十电子粒子,
写出该反应式__________________________
化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3。K为常见固态非金属单质,J为常见气态单质。其余为化合物,其中I、F在常温下为液态,C、D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品。F的浓溶液与K加热可生成D和H。(部分生成物未标出)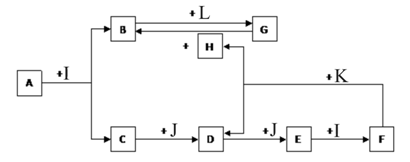
(1)写出下列物质的化学式:E J
(2)写出D通入足量稀Ba(NO3)2溶液反应的化学方程式:_______________________
(3)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理,在Al制容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,写出该反应的离子方程式_____________
(4)A电池性能优越,A-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为:2A+3AgO+2NaOH=2NaAO2+3Ag+H2O,下列说法正确的是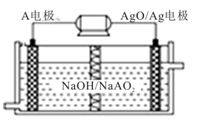
A.该隔膜是阳离子交换膜
B.当电极上析出1.08 g Ag时,电路中转移的电子为0.01 mol
C.A电极的反应式为:A-3e-+4OH-=AO2-+2H2O
D.正极的电极反应式为:O2+2H2O+4e-=4OH-