[化学—选修3:物质结构与性质]第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途。
(1)砷元素的基态原子价电子排布图为___________________。
(2)氮元素的单质除了N2外,还有N4,则N4中的N原子的轨道杂化方式为________________。
(3)对氨基苯甲醛与邻氨基苯甲醛相比,沸点较高的是_________(填空“前者”或“后者”),原因是_____________。
(4)汽车安全气囊的产生药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质,在NaN3固体中,阴离子的立体构型为_____________。
(5)王水溶解黄金的反应如下:Au+HNO3+4HCl=H[AuCl4]+NO+2H2O,产物中的H[AuCl4]是配合物,它的配位体是____________。
(6)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是变通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.已知砷化镓的晶胞结构如图,晶胞参数α=565pm。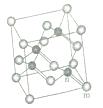
①砷化镓的化学式_________________,镓原子的配位数为________。
②砷化镓的晶胞密度=_____________g/cm3(列式并计算),m位置Ga原子与n位置As原子之间的距离为_________pm(列式表示)。
(1)已知:N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H="-905" kJ·mol-1
2H2(g)十O2(g)=2HO(g):△H=--483.6 kJ·mol-1
则N2(g)+3H2(g) 2NH3(g)的△H=。
2NH3(g)的△H=。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3);
②达到平衡时NH3的体 积分数为。
积分数为。
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它 内外
内外 表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A
表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A 上发生的电极反应式是。
上发生的电极反应式是。
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422℃,沸点1366,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
(1)A的化学式为。
(2)写出反应V的化学方程式。
(3)写出反应VI的离子方程式为。
(4)本工艺中可以循环利用的物质是(刚化学式表示)。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是。
(1)铝是一种重要的金属材料,铝热反应可以焊接钢轨,请写出铝在高温下与三氧化二铁反应的化学方程式
(2)某铝合金中含有合金元素镁、铜、硅,为了测定合金中铝的含量,设计了如下实验,请回答有关问题:
①称取样品ag,将样品溶于足量的稀盐酸,过滤;
②滤液中加入过量的氢氧化钠溶液,过滤,有关的离子方程式为:
③步骤②的滤液中通过足量的CO2气体,可产生Al(OH)3沉淀
④步骤③过滤后的滤渣用蒸馏水洗涤数次,烘干并灼烧至恒重,冷却后称量,其质量为bg,原样品中铝的质量分数为
(3)工业上,硅是在电炉中用炭粉还原二氧化碳硅制得的,写出该反应的化学方程式
,若往电炉中加入12g二氧化硅和足量炭粉的混合物,生成的气体在标准状况下的体积为。
化学电池在通讯、交通及日常生活中有着广泛的应用。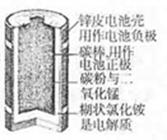
(1)右图是锌锰干电池的基本构造图,关于该电池的使用和性能,说法 正确的是
正确的是
A.该 电池可充电后反复使用
电池可充电后反复使用
B.该电池可用于闹钟、收音机、照相机等
C.该电池使用后能投入火中,也可投入池塘中
(2)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为: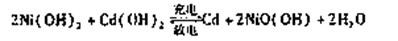
已知Ni(OH)2和Cd(OH)2均难于溶于但酸,以下说法正确的是 A.以上反应是可逆反应 B.反应环境为碱性
A.以上反应是可逆反应 B.反应环境为碱性
C.电池放电时Cd做负极 D.是一种二次电池
(3)美国阿波罗的氢氧燃料电池是一种新型电源,其构造如图所示,a、b两个电极均由多孔的碳块组成,通入氢气和氧气由孔隙中逸出,并在电极表面发生电极反应而放电。
①其电极为a是极(填正或负)
②若为飞行员提供了360kg的水,则电路中通过了mol电子。
25°C时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(m ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
(1)根据上图数据,写出该反应的化学方程式:;此反应的平衡常数表达式K=,从反应开始到达第一次平衡时的平均速率v(A)为。
(2)在5—7min内,若K值不变,则此处曲线变化的原因是
(3)下图表示此反应的反应速率v和时间t的关系图:
各阶段的平衡常数如下表所示:
 |
 |
 |
 |
 |
 |
 |
 |
K1、K2、K3、K4之间的关系为:(用“>”、“<”或“=”连接)A的转化率最大的一段时间是