减少二氧化碳的排放以及资源化利用具有重要意义。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0 kJ·mol一1,
C(s) +2H2O(g) = CO2(g) + 2H2(g) △H="+113.4" kJ·mol一1;
则反应:3FeO(s)+ H2O(g)= Fe3O4(s)+ H2(g)的△H=__________。
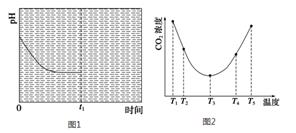
(2)目前 (NH4)2CO3已经被用作工业捕碳剂,为研究温度对(NH4)2CO3捕获CO2效率的影响,在T1温度下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图2)。则:
①该反应的ΔH 0(填“>”、“=”或“<”)。
②在T1~T2及T4~T5两个温度区间,容器内CO2气体浓度呈现如图2所示的变化趋势,其原因是 。
③该反应在温度为T1时,溶液pH随时间变化的趋势曲线如图1所示。当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化总趋势曲线。
(3)利用该反应捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有 (写出两条)。
A~H是由短周期元素组成的单质或化合物,其中A是淡黄色固体化合物,B是生活中最常见的无色液体,D是地壳中含量最多的金属元素的单质,F是典型的两性氧化物。它们之间的转化关系如下(部分生成物已略去):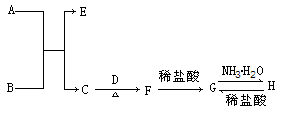
请回答下列问题
⑴写出下列物质的化学式:A、B、C、 E
⑵写出C+D→F的化学方程式:;
⑶G→H的反应过程中能观察到有色的沉淀生成;H→G的离子方程式是:
。
(7分)下表为元素周期表的前三周期。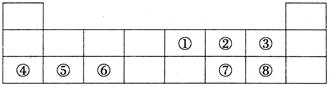
回答下列问题:
(1)写出元素符号⑤⑦。
(2)表中所列元素中,金属性最强的元素是(填元素符号,下同),非金属性最强的元素是;最高价氧化物对应水化物中,酸性最强的是(填化学式)。
(3)①、②、③三种元素的原子半径最大的是(填元素符号);④号元素与⑧号元素形成化合物的电子式为。
(1)在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g) pC(g)+qD(s)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
pC(g)+qD(s)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。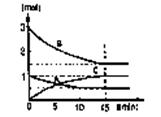
①该反应的平衡常数表达式为(各物质浓度的指数用数值表示):。
②若充入A,K值(填一定增大、一定减小、或可能增大也可能减小、不变);正反应速率____(填增大、减小、不变)。
③若体积为10升的密闭容器中,500℃、有催化剂存在的条件下,根据图示回答下列问题:在0~15min内的平均反应速率:v(B)=
(2)对于某可逆反应:A(g)+B(g) 2C(g)△H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
2C(g)△H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空: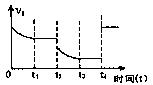
①写出t2时改变的条件可能是:(用文字表达);
②t4时改交的条件可能是(用编号表示,多选扣分)
A.增大压强 B.减小压强
C.使用催化剂 D.升高温度
E.增大A的浓度
(共12分)
(1)以CO2为碳源制取低碳有机物一直是化学领域的研究热点,CO2加氢制取低碳醇的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应II:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式_______________
(2)高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性
①电解法是工业上制备K2FeO4的一种方法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。电解时阳极发生反应生成FeO42-,该电极反应式为_________________
②与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,则该电池总反应的离子方程式为__________________
(3)amol FeS与bmol FeO投入到VL、C mol/L的硝酸溶液中充分反应产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为_____
①(a+b)×63g②(a+b)×189g③(a+b)mol④VC-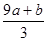 mol
mol
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有和以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:。
(3)“除杂”环节中,先加入溶液,经搅拌等操作后,过滤,再加入溶液调滤液PH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图14,由图可得,随着温度升高,
① 在相同时间K+的浸出浓度大。
② 在相同时间K+的浸出浓度减小
③ 反应的速率加快,平衡时溶浸时间短。
④ 反应速率减慢,平衡时溶浸时间增长。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:
已知298K时, Ksp(CaCO3)=2.80×10—9, Ksp(CaSO4)=4.90×10—5,求此温度下该反应的平衡常数K。