高纯度的绿矾(FeSO4·7H2O)是治疗缺铁性贫血的特效药。下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是___________________________。
(2)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是_______________________;
通入硫化氢至饱和的目的是:①除去操作I所得溶液中含有的Sn2+等杂质离子;
②除去Fe3+,反应的离子方程式为___________________________。
(3)操作IV的顺序依次为:___________、降温结晶。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②____________________________。
(5)测定绿矾产品中Fe2+含量的方法是:
a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol·L—1 KMnO4溶液滴定至终点,反应为:
5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O
消耗KMnO4溶液体积的平均值为20.00mL。
计算上述样品中FeSO4·7H2O的质量分数为______________________。
某课题组进行实验研究时,欲配制浓度均为1.0mol•L-1 的Ba(OH)2和H2SO4溶液。
Ⅰ.该组同学在配制Ba(OH)2溶液时,只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(相对分子质量:315),发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。
(1)用化学方程式解释未溶物产生的原因
(2)某同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。据此认为即便使用纯净的Ba(OH)2·8H2O,在室温下也不能配得1.0 mol•L-1Ba(OH)2溶液,其理由是:
Ⅱ.用18 mol•L-1的浓硫酸配制450 mL 1.0 mol•L-1稀硫酸。
(3)实验时,需量取浓硫酸的体积为mL,需用的主要仪器有量筒、烧杯、玻璃棒、、
(4)配制溶液时,定容的操作方法是:
(5)实验中下列情况会使所配溶液浓度偏高的是
| A.洗涤量取浓硫酸的量筒2~3次,并将洗涤液转入容量瓶中 |
| B.定容时仰视刻度线 |
| C.振荡摇匀后再重新加水至刻度线 |
| D.用水洗涤容量瓶未干燥 |
芳香化合物A是一种基本化工原料,可以从煤和石油中得到。A、B、C、D、E的转化关系如下所示: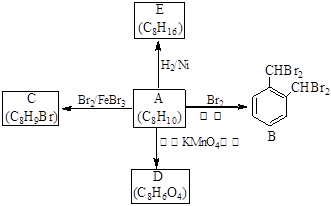
回答下列问题:
(1)A的化学名称是;E属于(填“饱和烃”或“不饱和烃”);
(2)A→B 的反应类型是,在该反应的副产物中,与B互为同分异构体的副产物的结构简式为;
(3)A→C的化学方程式为;
(4)A与酸性KMnO4溶液反应可得到D,写出D的结构简式。
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。加热某废塑料得到的产物如下表:
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
| 质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |

(1)试管B收集到的产品中,核磁共振氢谱显示有四个吸收峰的有机物与氢气加成后所得产物的一氯代物有 种。
(2)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。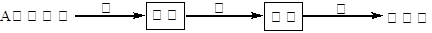
写出反应②的化学方程式。
(3)ZnC2、Al4C3、Mg2C3、Li2C2、Mg3N2等与CaC2和H2O反应相似。请通过对CaC2制C2H2的反应的思考,判断下列反应产物正确的是。
A.ZnC2水解生成乙烷(C2H6) B.Al4C3水解生成甲烷(CH4)
C.Mg2C3水解生成丙炔(C3H4) D.Li2C2水解生成乙烯(C2H4)
E.Mg3N2水解生成氨气(NH3)
某同学用12.5 mol/L浓硝酸来配制500 mL1 mol/L的稀硝酸,并进行有关实验。请回答有关问题:
(1)需要量取12.5 mol/L的浓HNO3________mL,配制该稀硝酸时使用的仪器除量筒、玻璃棒、烧杯外,还必须用到的仪器有______、___________等。
(2)取所配制的稀HNO3200 mL,与一定质量的铜粉充分反应,铜粉全部溶解后,生成的唯一还原产物NO气体在标况下的体积为0.56L。则:写出Cu与稀HNO3反应的化学方程式,参加反应的铜粉的质量为_________g。
(3)若要将溶液中Cu2+全部转化为Cu(OH)2沉淀,至少需加入0.2mol/L的NaOH溶液的体积为ml.
(注:要求在答题卡最下面方框内仅列出计算比例式)
已知4℃时四种化合物在水中和液氨中的溶解度如下表:
| AgNO3 |
Ba(NO3)2 |
AgCl |
BaCl2 |
|
| H2O(液) |
170g |
9.2g |
1.5×10-4g |
33.3g |
| NH3(液) |
86g |
97.2g |
0.8g |
0g |
上述四种物质在水中形成复分解反应的离子方程式为,在液氨中形成复分解反应的化学方程式为。