氯元素是生产生活中常见的非金属元素
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式: 。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a. 臭氧 b.NH3 c. 明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
① NaCl和Cl2中化学键的类型分别是 和 。
② 燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③ 已知:2H2O2(l) ="==" 2H2O(l)+O2(g) ΔH1=-196.46 kJ·mol-1
H2(g)+1/2O2(g) ="==" H2O(l) ΔH2=-285.84 kJ·mol-1
Cl2(g)+H2(g) ="==" 2HCl(g) ΔH3=-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
(4)工业上通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
完成Ⅰ中电解过程中阳极的反应式: 。
下面是关于药物华素片(西地碘片)使用说明书中的部分内容:
| 华素片(西地碘片)使用说明书 [品名和组成] 品名:西地碘片商品名:华素片英文名:Gydiodine Tablets 华素片(西地碘片)的主要活性成分是分子碘,含量1.5mg/片,将碘利用分子分散技术制成分子态西地碘,并含适量的薄荷脑等。 [贮藏] 遮光、密闭、在阴凉处保存。 [有效期] 二年 |
(1)根据上述说明和所学的化学知识回答:
①华素片中含有的活性成分是 (写分子式)
②请推断华素片 (“是”或“不是”)白色
(2)某学生为验证华素片中确实含有上述成分,完成实验如下。请填空:
①取一小粒药片放入研钵中研细,将药粉装入试管并加入约2mL蒸馏水,再向该试管中加入约2mL
(填选项字母),并用力振荡;
A.酒精 B.热裂汽油 C.四氯化碳 D.甘油
②描述加入该液体后可能观察到的现象是 。
某有机物的化学式为 C2H4O2,能与碳酸钠反应放出二氧化碳,则该有机物的结构简式是为 ,官能团的名称是_ _。
0.2molAl2(SO4)3中含有Al3+________mol、SO42-____________个。
填空题。
(1)用以下五种物质的编号进行填空:①甲烷②苯③乙醇④蚁酸⑤淀粉其中:
能发生银镜反应的是 ;燃烧时产生浓烟的是 ;分子结构是正四面体的是 ;
遇碘水显蓝色的是 ;工业上可用乙烯水化法制备得到的是 。
(2)按要求填空:
①葡萄糖的分子式 ; ②乙炔的电子式 ; ③2-甲基-1-戊烯的键线式 。
(3)写出下列反应的化学方程式:
①溴乙烷在氢氧化钠的醇溶液中共热 。
②乙酸乙酯在氢氧化钠的水溶液中共热 。
氯化钠是日常生活的必需品,也是重要的化工原料。粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。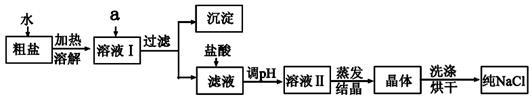
限选试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
(1)欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、_________、________;生成的沉淀含有的成分为泥沙、________。
(2)在滤液中加盐酸发生反应的离子方程式是____________________________________;
(3)对溶液II处理得到晶体时,所必须使用到的玻璃仪器有_________种。
(4)得到的NaCl纯品经测定发现其含有的NaCl与粗盐中NaCl的质量一致,某同学认为此次实验非常成功没有误差,你是否同意他的观点?_______(填“是”或“否”),并给出你的理由_______。