下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离度与浓度关系的是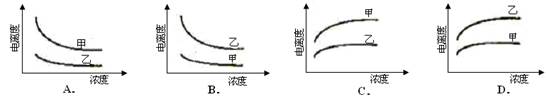
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐Q。下列有关说法错误的是
| A.该反应的化学方程式为:4NH3 + 3F2 → NF3 + 3NH4F |
| B.M是极性分子,其还原性比NH3强 |
| C.M既是氧化产物,又是还原产物 |
| D.4moNH3参加反应失去12mol电子 |
0.001mol金属放入10mL0.1mol/L某酸溶液中,产生22.4mL氢气(标准状况),下列情况中一定不可能的是
| A.一价金属和一元酸 | B.二价金属和二元酸 |
| C.三价金属和二元酸 | D.二价金属和一元酸 |
将下列各组物质提纯分离或除杂,可采用相同的实验方法和原理的是
| A.除去苏打中混有的少量小苏打杂质;除去氯化钠中混有的碘单质 |
| B.分离硝酸钾与氯化钠;分离氯化铁和氯化铜稀溶液 |
| C.除去二氧化碳中混有的少量二氧化硫;除去二氧化碳中混有的少量一氧化碳 |
| D.除去乙醛中溶有的少量乙酸;除去乙醇中溶有的少量苯酚 |
下列叙述中指定粒子数目一定大于NA的是
| A.常温常压下,11.2LN2和NO的混合气体所含的原子数 |
| B.1molCl2参加化学反应获得的电子数 |
| C.1L1mol/LCH3COOH溶液中所含分子总数 |
| D.28g铁在反应中作还原剂时,失去电子的数目 |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g)+Q,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
2NH3(g)+Q,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
下列叙述正确的是
| A.点a的正反应速率比点b的小 |
| B.点 c处反应达到平衡 |
| C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样 |
| D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大 |