研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g) + NaCl(s) NaNO3(s) + ClNO(g) K1 ∆H < 0 (I)
NaNO3(s) + ClNO(g) K1 ∆H < 0 (I)
2NO(g) + Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g) + 2NaCl(s)  2NaNO3(s) +2NO(g) + Cl2(g) 的平衡常数K= (用K1、K2表示)。
2NaNO3(s) +2NO(g) + Cl2(g) 的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”、“减小”或“不变”)。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2 + 2NaOH ="=" NaNO3 + NaNO2 + H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol·L‾1的CH3COONa溶液,则两溶液中c(NO3—)、c(NO2—)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10—4mol·L‾1,CH3COOH的电离常数K a=1.7×10—5mol·L‾1),可使溶液A和溶液B的pH相等的方法是 (选填序号)。
| A.向溶液A中加适量水 | B.向溶液A中加适量NaOH |
| C.向溶液B中加适量水 | D.向溶液B中加适量NaOH |
(17分)人工固氮是指将氮元素由游离态转化为化合态的过程。据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+ O2(g) △H="+765.0kJ" /mol。
O2(g) △H="+765.0kJ" /mol。
Ⅰ.请在下图所示的坐标中画出上述反应在有催化剂和无催化剂两种情况下反应体系中的能量变化示意图,并进行标注(包括△H)。
Ⅱ.目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ /mol。
2NH3(g) △H=-93.0kJ /mol。
回答下列问题:
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
① 表示N2的浓度变化的曲线是(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
(4)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ____________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ________mol。
某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、[Al(OH)4]-、SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液逐滴加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的上述离子是_______ ______,肯定不存在的离子是________________
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,开始产生沉淀,后沉淀会完全消失,再加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________。
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0
①该反应的平衡常数表达式为:K=
②该温度下,在2L盛有 粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是。
(3)Fe3+盐和Al3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性。但Fe3+只有在碱性介质中才能被氧化为FeO42-,请完成下列方程式:
Fe(OH)3 +ClO- + ==FeO42- + Cl- +;
(4)若将ag Fe和Al的混合物溶于2mol/L的足量的硫酸中,再往溶液中加入足量的6mol/L的NaOH溶液,充分反应,过滤,洗涤,干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为
用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
⑴用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________。
⑵除去蒸馏水中溶解的O2常采用________的方法。
⑶生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是______________________________。
方法二:如右图所示装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
⑷在试管Ⅰ里加入的试剂是____________。
⑸在试管Ⅱ里加入的试剂是____________。
⑹这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是____________________________。
某校化学研究性学习小组的同学在学习了氨的性质讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式 ;
(2)在实验室中,还可以用浓氨水与 (填写一种试剂)快速制取少量氨气;
(3)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为能否达到目的? (填“能”或“否”),理由是 。
(二)该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性: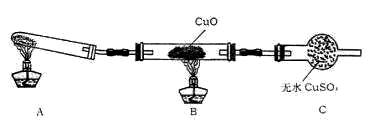
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式: 。