弱电解质的电离平衡、盐类的水解平衡和难溶电解质的溶解平衡均属于化学学习中的动态平衡。已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。
(1)Na2A溶液显碱性的原因 (用离子方程式回答);
(2)某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是 。
A.c(H+)·c(OH-)=1×10―14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq) △H>0。 Ksp=C(Ca2+)·C(A2—)
Ca2+(aq)+A2-(aq) △H>0。 Ksp=C(Ca2+)·C(A2—)
①降低温度时,Ksp (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,C(Ca2+) ,原因是 ;
(4)CaCO3是一种难溶物质,其Ksp=2.8×10—9,CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
下列共有十二种化学符号:
①O2②614C③238U④1123Na⑤O3⑥714N⑦1224Mg⑧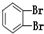
⑨235U⑩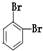 (11)
(11)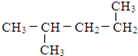 (12)
(12)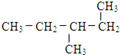
其中:
(1)表示核素的符号共有___种.
(2)互为同位素的是___(填序号,以下相同)
(3)质量数相等,但不能互称同位素的是__
(4)中子数相等,但质子数不相等的是___.
(5)互为同素异形体的是___.
(6)互为同分异构体的是___.
(实验班做)
恒温下,将a mol N2与b mol H2的混合气体通入一个固体容积的密闭容器中,发生如下反应:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol, a="________" 。
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。nt(NH3) __________。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)= _____。
(4)原混合气体中,a:b=_____。
(5)将1molN2和3molH2合成NH3反应时,下列叙述能说明该反应已达到化学平衡状态的是(填标号)_________ ;
A 容器内的总压强不随时间而变化
B反应后混合气体的密度不再发生变化
C三种气体的浓度相等且保持不变
D NH3的分解速率与生成速率相等
E.混合气体的平均相对分子质量不再发生变化
(普通班做)
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白: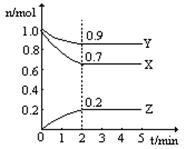
(1)该反应的化学方程式为;
(2)从开始至2min,Z的平均反应速率为;
平衡时,X的转化率为;平衡时,Y的浓度为;
(3)下列叙述能说明该反应已达到化学平衡状态的是(填标号);
A容器内压强不再发生变化
B X的体积分数不再发生变化
C容器内气体原子总数不再发生变化
D相同时间内消耗2n mol的Z的同时消耗n mol的Y
E. 相同时间内消耗n mol的Y的同时消耗3n mol的X
(实验班做)
现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式______________________________________________________________________。
(2) 化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:___________________________________________。
(3) 某原电池中,电解质溶液为稀H2SO4,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应:________________________;
负极反应:________________________;
电解质溶液pH的变化_______.(填“增大”“减小”或“不变”.下同)
(普通班做)
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 |
元素性质与原子(或分子)结构 |
| T |
最外层电子数是次外层电子数的3倍 |
| X |
常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y |
M层比K层少1个电子 |
| Z |
第3周期金属元素的简单离子中半径最小 |
(1)画出元素T的原子结构示意图__________________________;
(2)元素Y与元素Z相比,金属性较强的是__________________(用元素符号表示),下列表述中能证明这一事实的是_________________(填序号);
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式______,并写出该化合物与水反应的离子方程式______;