某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是_______________。
(2)该反应中,发生还原反应的过程是 → 。
(3)该反应中氧化剂与还原剂物质的量之比为 。
(4)如反应转移了0. 3mol电子,则产生的气体在标准状况下体积为 。
某温度下,在2L密闭容器中,3种气态物质 X、Y、Z的物质的量随时间变化曲线如图,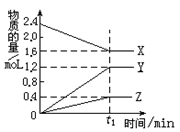
⑴① 该反应的化学方程式是_____________________。
②在t1min时,该反应达到了__________状态,下列可作为判断反应已达到该状态的是__________
| A.X、Y、Z的反应速率相等 | B.X、Y的反应速率比为2:3 |
| C.容器内气体压强保持不变 | D.生成1molZ的同时生成2molX |
⑵ ①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则该反应的热化学反应方程式为:__________________________。
②两位同学讨论放热反应和吸热反应。甲说加热后才能发生的化学反应是吸热反应,乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们说法正确的是______同学。
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,B与C的单质在加热条件下反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)写元素符号:A为 ,B为 ,C为 。
D的最高价氧化物的水化物化学式是。
(2)写出A、B形成的化合物与E反应的化学方程式: 。
(3)E属(“离子”或“共价”)化合物。E中含键。
(4)D元素在周期表中位于第_____周期______族。
已知A、B、C、D为气体(其中A为黄绿色),E是常见的氮肥,F为固体,G是氯化钙,它们之间的转换关系如下图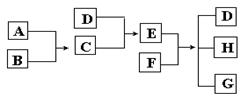
⑴ D的结构式是_____________,E的化学式(分子式)是_____________。
⑵ D和O2反应的化学方程式是______________________________。
⑶ E和F反应生成D、H和G的化学方程式是___________________________________。
⑴完成下列物质的电子式:
KOH; H2S;
CS2; NH4Cl;
⑵下列微粒之间,属于同位素的是,(填序号,下同)属于同素异形体的是,属于同分异构体的是,固体时属于原子晶体的是。
| A.正丁烷与异丁烷 |
| B.红磷与白磷 |
| C.氕与氚 |
| D.氯化钠与干冰 |
E.金刚石与水晶
F.氧气和臭氧
G. 13C和14C
H.CH3OCH3和CH3CH2OH
⑶亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
Na2SO3+KIO3+H2SO4——Na2SO4+K2SO4+I2+H2O
(a)配平上面的氧化还原反应方程式,将系数填入方框中。
(b)其中氧化剂是,若反应中有5 mol电子转移,则生成的碘是mol。
①NaCl、②干冰、③冰、④Na2O2、⑤白磷(P4)、⑥金刚石、⑦Na2CO3、⑧钠。以上物质中属于离子晶体的是 ________ ;属于分子晶体的是(填序号)。氯化钡是无色晶体,溶于水,水溶液能导电,熔点1 560 ℃。它可能属于 ______ 晶体。