已知A—K均为短周期元素形成的常见物质,H、I为气体单质,c为一种无色液体,I和K是工业上重要的还原剂,反应②是重要的化工反应原理,且它们有如下的转化关系:
(1)分别写出F、K的化学式: F , k 。
(2)写出反应②的离子方程式
(4)反应②的原料F常常从自然界中获得.但其中常含有Ca2+、Mg2+、Fe3+和SO42-等杂质,因此需要精制除去杂质,现设计一套方案如下.请回答:
其中:试剂3为 ;试剂4作用除 ;操作Ⅰ的名称为
按要求写出下列反应方程式(请注明反应条件),并按要求填空
(1)实验室制备乙烯的化学方程式,反应类型是。
(2)乙酸与乙醇发生反应的化学方程式,反应过程中乙酸断裂的是键,乙醇断裂的是 键。
(3)2-溴丙烷与氢氧化钠水溶液共热的化学方程式,此反应将卤代烃类物质转化为类物质。
(4)乙醛发生银镜反应。
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)。
(1)硝酸在该反应中的作用是__________________。该反应的还原产物是________________
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________。
下图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性;I是一种金属单质;F、M、N均为难溶于水的白色沉淀,其中M和N不溶于稀硝酸;C和D是两种常见的强酸。请回答下列问题: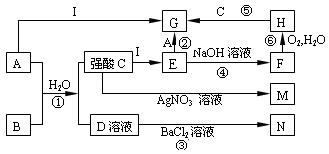
(1)写①的化学方程式______________________________________
(2)写反应②的离子方程式__________________________________
(3)写出将A通入石灰乳的化学方程式________________________
(4)在①②③④⑤⑥中,属于氧化还原反应的有:_______________(填编号)
(1)某建筑材料,主要成分铝硅酸盐,化学式MgAl2H4Si4O14;化学式改写成氧化物形式为_____________。则材料该与足量的氢氧化钠反应后过滤,滤渣主要是______.写出该过程中发生的离子方程式_______________________________、_______________________________________。
(2)检验CO2中是否混有SO2可将气体通过盛有______的洗气瓶.
(3)鉴别Na2CO3和NaHCO3溶液可选用______(填序号).
①NaOH ②Ca(OH)2③BaCl2④K2SO4 ⑤Ca(NO3)2
(4)某溶液中有NH4+,Mg2+,Fe2+,Al3+四种离子,若向其中加入过量的氢氧化钠溶液,加热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是______.
| A.NH4+ | B.Mg2+ | C.Fe2+ | D.Al3+ |
(5)6.4gCu与过量硝酸(60mL 8mol/L)充分反应后,硝酸的还原产物有NO、NO2,反应后溶液中所含H+为n mol,NO、NO2混合气体的物质的量为________________
利用化合价推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①SO2的性质________________(填序号,下同)
A.只有氧化性B.只有还原性C.既有还原性又有氧化性
②SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应后,锰元素被还原成Mn2+,写出上述反应的离子方程式_________________________________
(2)Fe(OH)2很不稳定,露置在空气中容易被氧化,发生反应的离子方程式为__________________________________________________为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配置的NaOH溶液反应制备。
①用硫酸亚铁晶体配置上述硫酸亚铁溶液时,还需加入_________来防止Fe2+被氧化
②除去蒸馏水中溶解的O2常采用_______的方法
(3)检验Fe3+的方法:_______________________(写出加入试剂的化学式和现象与结论)