向20 mL某物质的量浓度的AlCl3溶液中滴入2 mol·L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:


(1)图中A点表示的意义是_________________________。
(2)图中B点表示的意义是_________________________。
(3)上述两步反应用总的离子方程式可表示为:__ ____。
(4)若所得Al(OH)3沉淀0.39 g,则此时用去NaOH溶液的体积为____________。
4.8 g O2和0.2 mol CO2,它们的物质的量之比是________,质量之比是________,在同温同压下的体积之比是________。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.加热分解法 | C.结晶法 | D.分液法 |
E.蒸馏法 F.过滤法
(1)分离饱和食盐水与沙子的混合物________。
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾________。
(3)分离水和汽油的混合物________。
(4)分离四氯化碳(沸点为76.6℃)和甲苯(沸点为110.6℃)的混合物________。
(5)从碘的水溶液里提取碘________。
(13分)(1)已知:H2(g)+O2(g) H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则: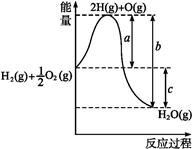
①a、b、c分别代表什么意义?
a
b
c
②该反应是反应(填“吸热”或“放热”),ΔH0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是,
。(请写两条)
(3)已知:H2(g)+1/2O2(g) H2O(l) ΔH="-285.8" kJ·mol-1
H2O(l) ΔH="-285.8" kJ·mol-1
H2(g) H2(l) ΔH="-0." 92 kJ·mol-1
H2(l) ΔH="-0." 92 kJ·mol-1
O2(g) O2(l) ΔH="-6.84" kJ·mol-1
O2(l) ΔH="-6.84" kJ·mol-1
H2O(l) H2O(g) ΔH="+44.0" kJ·mol-1
H2O(g) ΔH="+44.0" kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式:
(9分)依据叙述,写出下列反应的热化学方程式。
(1)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为____________________________________________________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为____________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为__________________________________________________。
(16分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是、。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”),其原因是。
(3)他们记录的实验数据如下:
| 实验用品 |
溶液温度 |
中和热 |
|||
| t1 |
t2 |
ΔH |
|||
| ① |
50 mL 0.55 mol·L-1 NaOH溶液 |
50 mL 0.5 mol·L-1 HCl溶液 |
20 ℃ |
23.3 ℃ |
|
| ② |
50 mL 0.55 mol·L-1 NaOH溶液 |
50 mL 0.5 mol·L-1 HCl溶液 |
20 ℃ |
23.5 ℃ |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:。
(4)若用KOH代替NaOH,对测定结果(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果(填“有”或“无”)影响。