对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。请回答以下问题:(1)硫酸工厂的酸性废水中砷(As)元素(主要以弱酸H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉降法处理含砷废水。
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为 ,AsH3的稳定性比NH3的稳定性 (填“强’’或“弱’’)。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成难溶的三硫化二砷,该反应的离子方程式为 。
(2)今年8月1 2日晚,天津滨海新区危险品仓库发生爆炸事故,少量氰化物因爆炸冲击发生泄漏,CN一有剧毒,泄露会污染水源和空气,需要处理。
①已知HCN力一元弱酸,则NaCN溶液的pH 7(填“>”“=”或“<”)。
②处理含CN一废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3一,同时生成NH3,该反应的离子方程式为 方法二:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 。
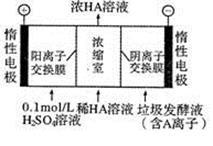
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如右图所示(图中“HA”表示乳酸分子,A表示乳酸根离子)。阳极的电极反应式为 简述浓缩室中得到浓乳酸的原理
I.施安卡因(G)是一种抗心律失常药物,可由下列路线合成。
(1)已知A是 的单体,则A中所含官能团的名称是。
的单体,则A中所含官能团的名称是。
(2)B的结构简式为;用系统命名法给C命名为。
(3)C与足量NaOH醇溶液共热时反应的化学方程式为。F→G的反应类型为。
(4)L是E的同分异构体,分子中含有苯环且苯环上一氯代物只有两种,则L所有可能的结构简式有 、、、。
、、、。
Ⅱ.H是C的同系物,其核磁共振氢谱有两个峰。按如下路线,由H可合成高聚物V
(5)H的结构简式为__________。
(6)Q→V反应的化学方程式______________________________。
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1。
请回答下列问题。
(1)C原子基态时电子排布式为。
(2)B、C两种元素第一电离能为>(用元素符号表示)。试解释其原因: 。
(3)任写一种与AB-离子互为等电子体的离子。
(4)B与C形成的四原子阴离子的立体构型为,其中B原子的杂化类型是。
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式。
(6)D和E形成的化合物的晶胞结构如图,其化学式为;∠EDE= ;E的配位数是;已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶胞边长a=cm。(用ρ、NA的计算式表示)
鄂尔多斯市已探明煤炭储量1496亿多吨,约占全国总储量的1/6。煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题。
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为和。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为
FeS2 Fe2++SO42-
Fe2++SO42- Fe3+
Fe3+
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为,第二步反应的离子方程式为。
(3)工业煤干馏得到的产品有焦炭、。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=,实际生产要将r值维持在1.7~2.2之间,原因是。
298 K时,某容积固定为1 L的密闭容器中发生如下可逆反应:A(g) 2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
试回答下列问题。
(1)已知298 K时60 s达到平衡,比较40~60 s内和60~80s内B的平均反应速率:v(40~60)v(60~80)(填“﹥”或“﹦”或“﹤”)。
(2)若298 K达到平衡时,B的平衡浓度为A的3倍,共放出热量x kJ,开始加入A的物质的量是mol。
(3)298k时,该反应的平衡常数为mol/L。
(4)若反应在298 K进行,在1 L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡时共吸收热量y kJ,此时B的转化率为(填序号)。
A.等于60% B.等于40%
C.小于40% D.介于40%~60%之间
(5)结合(2)、(4)相关数据,写出a、x、y三者的等式关系式:。
(6)若反应在298K进行,反应起始浓度为c(A)=c(B)=1.0mol/L,则化学平衡将(填“正向”“逆向”或“不”)移动。
(7)已知曲线上任意两点之间连线的斜率表示该时间段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),则曲线上任意一点的切线斜率的意义是。
Ⅰ.高铁酸钾(K2FeO4)是极好的氧化剂,具有高效的消毒作用,为一种新型非氯高效消毒剂。其生产工艺流程如下:
请同答下列问题。
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式。
(2)在溶液I中加入KOH固体的目的是(选填序号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解会放出较多的热量,有利于提高反应速率和KClO的纯度 |
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为。要制得69.3克K2FeO4,理论上消耗氧化剂的物质的量为mol。
(4)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,
3Zn+2K2FeO4+8H2O,
放电时电池的负极反应式为。
Ⅱ.肼(N2H4)又称联氨,是一种可燃性的液体,用作火箭燃料。
(5)写出肼分子的电子式。
(6)肼能与N2O4反应:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ/mol。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol, 写出肼与O2反应生成N2和H2O(g)的热化学方程式。