某些天然气开采中含有H2S气体,为了安全、有效地利用这一资源,提高经济价值,工业上可以采取多种处理方式。
Ⅰ.吸收:
(1)加工过程中常用氨水吸收H2S,产物为NH4HS,请写出对应的化学方程式: 。
Ⅱ.再利用:加工过程中产生的H2S废气可用来制H2,既廉价又环保。工业上采用以下两种方法制备H2
1高温热分解法
已知:H2S(g) H2(g)+S(g) △H
H2(g)+S(g) △H
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。请回答:

(2)△H 0(填 “>”或者“<”),你判断的依据是: 。
ii.图中a为H2S的平衡转化率与温度关系曲线,
(3)据图计算985℃时H2S按上述反应分解的平衡常数K=________
2电化学法
已知:该法制氢过程的示意图如右,FeCl3溶液可作为H2S的吸收液。
请回答:
(4)反应池中发生反应的离子方程式为_____________。
(5)请结合化学用语解释说明该装置能够产生H2的原因 。
(6)该装置除了能够制氢外,还具有何种优点?请你评价 。
I.已知有如下氧化还原反应:Zn+2HNO3+NH4NO3=N2↑+Zn(NO3)2+3H2O,则:
(1)该反应的还原剂为 ,还原产物为 。(写化学式)
(2)若产生的N2在标准状况下体积为2.24L,则反应中转移的电子数为 NA。
II.化学与我们的生活密切相关,请用化学方程式描述以下生活中的实例:
(1)盛有NaHCO3的干粉灭火器用于灭火
(2)铁质菜刀的“淬火”工艺:将红热的菜刀浸入水中急速冷却
(3)饲养金鱼用的自来水必须经过太阳暴晒后才能使用
由人尿分离出来的结晶化合物A,熔点为187~188 ℃。对化合物A做下列实验:
(1)测得A的蒸气密度为8.00 g·L-1(已折合成标准状况),取17.92 g A完全燃烧,生成的气体通过浓H2SO4,使浓H2SO4增重8.10 g。剩余气体通过碱石灰,气体质量减轻39.60 g;另取17.90 g A完全分解,可得标准状况下氮气1.12 L,试通过计算确定A的化学式_______。
(2)又知A和足量6 mol·L-1的盐酸混合加热可以完全水解,1 mol A水解生成1 mol B和1 molC。已知A、B、C三物质分子中均含有1个羧基;B物质仅由碳、氢、氧3种元素组成,其物质的量之比为7∶6∶2;C俗名为甘氨酸。写出A、B、C的结构简式。A_______,B_______,C_______。
紫杉醇是一种新型抗癌药,其分子式为C47H51NO14,它是由如下的A酸和B醇生成的一种酯。
A. 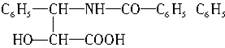 —是苯基
—是苯基
B.R—OH(R是一个含有C、H、O的基团)
(1)A可在无机酸催化下水解,其反应的方程式是___________________________。
(2)A水解所得的氨基酸,不是天然蛋白质水解产物,因为氨基不在____(填希腊字母)位。
(3)写出ROH的分子式_________________________。
科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理。为此他们荣获了1998年诺贝尔生理学和医学奖。
请完成下列问题:
(1)已知M的相对分子质量为227,由C、H、O、N 4种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是________。D是双原子分子,相对分子质量为30,则D的分子式为________。
(2)油脂A经下列途径可得到M。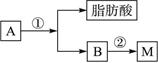
图中②的提示: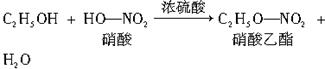
反应①的化学方程式是______________________________________________________。
反应②的化学方程式是______________________________________________________。
(3)C是B和乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式:______________________________________________。
(4)若将0.1 mol B与足量的金属钠反应,则需消耗________g金属钠。
某天然油脂A的分子式为C57H106O6,1 mol该油脂水解可得到1 mol甘油、1 mol不饱和脂肪酸B和2 mol直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。
(1)写出B的分子式:_____________________________。
(2)写出C的结构简式:___________________________。
C的名称:________________________。
(3)写出含有5个碳原子的C同系物的同分异构体的结构简式:___________________。