为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)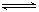 2NO2(g),下列各项能说明反应达到平衡状态的是 。
2NO2(g),下列各项能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1 molO2同时生成2 molNO2
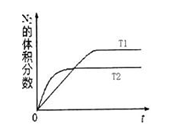
(2)汽车内燃机工作时会引起N2和O2的反应:N2 + O2 2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)
2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。
(3)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化如图所示: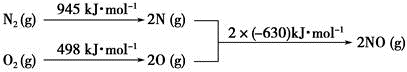
写出该反应的热化学方程式:________________________________。
Ⅱ.碳氧化物研究
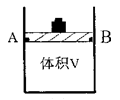
(1)在体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如右图所示,现将3molH2和2molCO放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成甲醇的反应如下:CO(g)+2H2(g) CH3OH(g)。测定不同条件、不同时间段内的CO的转化率,得到如下数据:
CH3OH(g)。测定不同条件、不同时间段内的CO的转化率,得到如下数据:
| CO的转化率 T(℃) |
10min |
20min |
30min |
40min |
| T1 |
20% |
55% |
65% |
65% |
| T2 |
35% |
50% |
a1 |
a2 |
①根据上表数据,请比较T1_________T2(选填“>”、“<”或“=”);T2℃下,第30min 时,a1=________,该温度下的化学平衡常数为_______________。
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人6molCO,此时v(正)________v(逆)(选填“>”、“<”或“=”),判断的理由是 。
(2)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_________________(用含a和b的代数式表示)。
将6 mol H2和3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:2 H2(气) + CO(气)  CH3OH(气),6秒时体系达到平衡,此时容器内气体的物质的量为开始时的0.6倍,求(1)H2的反应速率;
CH3OH(气),6秒时体系达到平衡,此时容器内气体的物质的量为开始时的0.6倍,求(1)H2的反应速率;
(2)CO的转化率;
(3)求相同条件下CH3OH(气)  2 H2(气) + CO(气)的平衡常数K
2 H2(气) + CO(气)的平衡常数K
下图是某工厂生产甲醇(CH3OH)的工艺流程图: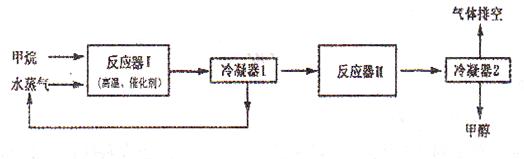
已知,在反应器II中CO在高温、高压、催化剂存在的条件下跟H2充分反应后,仍剩余1/3。请回答下列问题:
(1)在反应器I中,发生反应的化学方程式是_______________________ _____________。
_____________。
(2)从提高原子的利用率出发,该生产工艺需要进行的改进是_____________________。
(3)右图表示CO和H2反应合成甲醇过程中的能量变化,曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂时反应的能量变化。则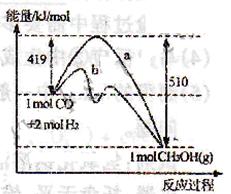
①反应的热化学方程式为___________________________________________。
②在恒容条件下,能使该反应的平衡常数改变的措施有_________________。(填字母)
| A.加压 |
| B.降低温度 |
| C.再充入1mol CO和2molH2 |
| D.使用更高效的催化剂。 |
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)今有如下两个热化学方程式:则ab(填>, =" ," <)
H2(g)+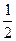 O2(g) = H2O(g) ΔH1=a kJ·mol-1
O2(g) = H2O(g) ΔH1=a kJ·mol-1
H2(g)+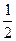 O2(g) = H2O(l)ΔH2=b kJ·mol-1
O2(g) = H2O(l)ΔH2=b kJ·mol-1
(2)由气态基态原子形成1mol化学键释放 的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 |
H-H |
N-H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2(g)+3H2(g)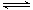 2NH3(g)△H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________。
2NH3(g)△H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s)和H2(g)生成1mol C2H2(g)反应的反应热
△H =____________________ __。
__。
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As为砷元素)
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成1 mol X,则X的化学式为________。
(3)根据上述反应可推知________。
a.氧化性:KBrO3>H3AsO4 b.H3ASO4是还原产物
c.还原性:AsH3>X d.K2SO4和H2O是还原产物
(4)请将反应物的化学式和配平后的系数填入下列相应的位置中,并用“单线桥”标出电子转移的方向和数目。
某无色溶液,由Na+、Ba2+、Al3+、Cl-、MnO4-、CO32-、NO3-中的若干种组成。,现取两份100 mL溶液进行 如下实验:
如下实验:
① 第一份小心蒸发得溶质3.08g;
② 第二份加足量AgNO3溶液后,得干燥沉淀5.63g,向沉淀中加入足量盐酸,生成标准状况下气体0.224L。
根据上述实验回答下列问题:
(1)第二份溶液所得沉淀的成分是 ,其物质的量分别是 。
(2)写出步骤②中所发生的所有反应的离子方程式
。
(3)一定存在的离子是 ,其浓度分别是 。