软锰矿(主要成分为MnO2)可用于制备锰及其化合物。
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为 。
(2)现代冶炼金属锰的一种工艺流程如下图所示:

下表为t℃时,有关物质的pKsp(注:pKsp =-lgKsp)。
| 物质 |
Fe(OH)3 |
Cu(OH)2 |
Ca(OH)2 |
Mn(OH)2 |
CuS |
CaS |
MnS |
MnCO3 |
| pKsp |
37.4 |
19.32 |
5.26 |
12.7 |
35.2 |
5.86 |
12.6 |
10.7 |
软锰矿还原浸出的反应为:12MnO2 + C6H12O6 + 12H2SO4=12MnSO4 + CO2↑+18H2O
①该反应中,还原剂为__________。写出一种能提高还原浸出速率的措施: 。
②滤液1的pH (填“>”、“<”或“=”)MnSO4浸出液的pH。
③加入MnF2的主要目的是除去 (填Ca2+、Fe3+或Cu2+)
(3)由MnSO4制取MnCO3
往MnSO4溶液中加入过量NH4HCO3溶液,,该反应的离子方程式为_____________________;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s) + 2OH-(aq) Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。
Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。
X、Y、Z、W、M是元素周期表中原子序数依次增大的五种元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
元素周期表中核电荷数最小的元素 |
| Y |
Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z |
Z是大气中含量多的元素,其某些氧化物为大气中常见的污染物 |
| W |
W是地壳中含量最高的金属元素 |
| M |
常见金属,单质呈紫红色 |
(1)W位于元素周期表第周期第 族;W的简单离子半径比Z的简单离子半径(填“大”或“小”)。
(2)Z原子的第一电离能比氧原子的(填“大”或“小”);M的基态原子价电子排布式是
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是,空间构型是
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途: 、;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:____。
(5)可用YX4还原ZOx以消除其污染。已知:
YX4 (g) +4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g) △H=" -" 574 kJ·mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g) +2X2O(g) △H =" -" 1160 kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:____。
四种短周期非金属元素A、B、C、D,原子序数依次增大。A是原子半径最小的元素,B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是________。
(2)化合物A2D的电子式是________,结构式为________。
(3)B、D两元素形成化合物属 (“离子”或“共价”)化合物。
下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是,可用于制半导体材料的元素是_______。
(2)B的最高价氧化物对应的水化物与C的单质反应的化学方程式为,
(3)最高价氧化物对应的水化物中酸性最强的是;
(4)A分别与D、E、G、H形成的化合物中,最稳定的是;
(5)在B、C、D中,原子半径由大到小的顺序是。
(6分)比较下列性质(填“>”、 “<” 、“=”):
①径:NaF
②酸性:H2CO3HNO3
③碱性:NaOHMg(OH)2
④金属性:KRa
⑤稳定性:H2OH2S
⑥非金属性:CF
(1)有① 、
、 、
、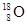 ②H2、D2、T2③石墨、金刚石 ④
②H2、D2、T2③石墨、金刚石 ④ 、
、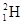 、
、 四组微粒或物质,互为同位素的是________(填编号,下同)。互为同素异形体的是________。
四组微粒或物质,互为同位素的是________(填编号,下同)。互为同素异形体的是________。
(2)在 H、
H、 H、
H、 H、40K、40Ca、14N、14C中共有_______种元素,_______种原子,中子数最多的是_______。
H、40K、40Ca、14N、14C中共有_______种元素,_______种原子,中子数最多的是_______。