某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是
①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
②等物质的量浓度Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:
c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3)
③pH相等的四种溶液:a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH。(已知酸性:C6H5OH<H2CO3)其溶液 物质的量浓度由小到大顺序为:d、b、c、a
④1L0.1mol/LNH4NO3溶液中氮原子数小于0.2NA
⑤pH=4.5的浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
⑦把0.1mol/L的NaHCO3溶液与0.3mol/LBa(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba2+)>c(Na+)>c(H+)
⑧在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度不同
| A.①②③⑤ | B.③⑤⑥⑦ | C.①③④⑥ | D.②③⑥⑦ |
下面关于SiO2晶体网状结构的叙述正确的是
| A.存在四面体结构单元,O处于中心,Si处于4个顶角 |
| B.最小的环上,有3个Si原子和3个O原子 |
| C.最小的环上,Si和O原子数之比为1:2 |
| D.最小的环上,有6个Si原子和6个O原子 |
下列叙述正确的是
A.在醋酸溶液的 ,将此溶液稀释1倍后,溶液的 ,将此溶液稀释1倍后,溶液的 ,则 ,则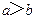 |
B.在滴有酚酞溶液的氨水里,加入 至溶液恰好无色,则此时溶液的 至溶液恰好无色,则此时溶液的 |
C.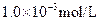 盐酸的 盐酸的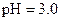 , , 盐酸的 盐酸的 |
D.若1mL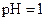 的盐酸与100mL 的盐酸与100mL 溶液混合后,溶液的 溶液混合后,溶液的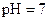 则 则 溶液的 溶液的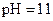 |
能正确表示下列反应的离子方程式是
A.将铜屑加入 溶液中: 溶液中: |
B.将磁性氧化铁溶于盐酸: |
C.将氯化亚铁溶液和稀硝酸混合: |
D.将铁粉加入稀硫酸中: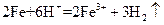 |
一定条件下磷与干燥氯气反应,若0.25g磷消耗掉314mL氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于
| A.1:2 | B.2:3 | C.3:1 | D.5:3 |
下图表示4—溴环己烯所发生的4个不同反应。其中,产物只含有一种官能团的反应是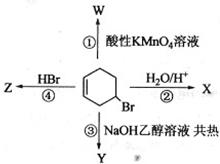
| A.①④ | B.③④ | C.②③ |
D.①② |