25℃,两种酸的电离常数如下表。
| |
Ka1 |
Ka2 |
| H2A |
1.3×10-2 |
6.3×10-6 |
| H2B |
4.2×10-7 |
5.6×10-7 |
下列叙述中正确的是
A.H2A的电离方程式:H2A=2H++A2-
B.常温下,在水中Na2B的水解平衡常数为:
C.等浓度的Na2A和Na2B溶液,由水电离产生的H+浓度大小关系为:前者大于后者
D.向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2A=A2-+H2B
下列说法正确的是()
| A.酸和碱发生中和反应生成水,这时的反应热叫中和热 |
| B.燃烧热或中和热是反应热的种类之一 |
| C.在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 |
| D.在稀溶液中,1molCH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ |
可充电电池因其可以反复使用而深受广大消费者喜爱。请你根据对可充电电池的理解,选出下列有关说法正确的是 ( )
| A.放电时,正极发生氧化反应 | B.放电时,把热能转化为电能 |
| C.充电时,电池的负极发生还原反应 | D.充电时,把化学能转化为电能 |
下列关于电解质叙述正确的是()
| A.CO2溶于水能部分电离,故CO2属于弱电解质 |
| B.溶于水后能电离出氢离子的化合物都是酸 |
| C.硫酸钡难溶于水,但硫酸钡属强电解质 |
| D.强电解质溶液的导电性比弱电解质溶液的导电性强 |
下列说法正确的是( )
| A.Ca2+的核外电子排布1s22s22p63s23p64s2 |
B.铁原子的价电子排布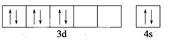 |
| C.某原子的核外电子排布式为1s22s22p63s23p63d54s1,则其成单电子数为2 |
| D.各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7 |
高铁电池是一种新型可充电电池,电解质溶液为KOH,放电时的总反应式为:3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是()
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是()
| A.放电时负极反应为:3Zn — 6e-+6OH- ="=" 3Zn(OH)2 |
| B.放电时OH-向正极移动 |
| C.充电时每转移3 mol电子,阳极有1 mol Fe(OH)3 被还原 |
| D.充电时阳极反应式为:3Zn(OH)2+6e- ="=" 3Zn+6OH- |