硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
其它性质 |
| SO2Cl2 |
-54.1 |
69.1 |
①易水解,产生大量白雾 ②易分解:SO2Cl2  SO2↑+Cl2↑ SO2↑+Cl2↑ |
| H2SO4 |
10.4 |
338 |
吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
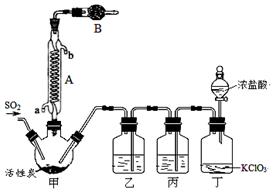
(1)仪器A冷却水的进口为 (填“a”或“b”)。
(2)仪器B中盛放的药品是 。
(3)实验时,装置丁中发生反应的离子方程式为 。
(4)装置丙的作用为 ,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为 。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液): 。
下表为周期表的一部分,其中的编号代表对应的元素。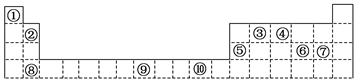
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)写出元素⑨的基态原子的电子排布式 。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为对。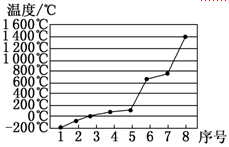
(4)第3周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填元素符号)。
以 HCHO 和 C2H2为有机原料,经过下列反应可得化合物 N ( C4H8O2)。
( l )反应Ⅰ的反应类型为。
( 2 ) HOCH2C≡CCH2OH 分子中,在同一个平面的原子最多有个。
( 3)化合物 M 不可能发生的反应是(填序号)。
A.氧化反应 B.取代反应 C.消去反应 D.加成反应 E.还原反应
( 4 ) N 的同分异构体中,属于酯类的有种。
( 5 ) A 与 M 互为同分异构体,有如下转化关系。
填写下列空白:
① A 的结构简式为,B 中的官能团名称是。
② D 的化学式为。
③ 写出 B 与银氨溶液反应的化学方程式:_。
④ 在120℃时,由 A、B、E组成的混合物w g与氧气充分反应,生成产物全部为气体时,消耗氧气[m (O2)]的质量范围为。
某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为:
(2)A与溴的四氯化碳溶液反应的化学方程式为
(3)已知: 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式;
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式;
反应类型是;
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式;
(10分,每小题2分,共5小题)
(1)某炔烃B和H2充分加成后生成2,5-二甲基己烷,则B的结构简式为;
(2)碳原子数在10以内的烷烃的所有同分异构体中,一氯代物无同分异构体的有()种
(3)某一元羧酸A,含碳的质量分数为50.0%,氢气、溴、溴化氢都可以跟A起加成反应。试求:A的结构简式
(4)在一定质量的烧瓶中盛10g11.6%的某醛溶液,然后与足量的银氨溶液充分混合放在热水浴中加热,安全反应后,倒去瓶中液体,仔细洗净、烘干后,烧瓶质量增加4.32g,通过计算,写出这种醛的结构简式
(5)0.2 mol某有机物和0.4 mol O2在密闭容器中燃烧后,产物为CO2、CO和H2O,产物经过浓H2SO4后,浓H2SO4增重10.8 g,通过灼热的CuO充分反应后,CuO失重3.2 g,最后通过碱石灰,碱石灰增重17.6 g。若等量该有机物与9.2 g 钠恰好反应。计算并回答:该有机物的名称。
有机物A的结构简式为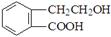 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。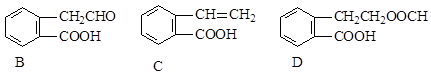
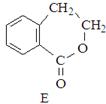
请回答下列问题:
(1)在A--E五种物质中,互为同分异构体的是(填代号)。
(2)写出由A生成B的化学方程式 。
由A生成C的反应类型为。
(3)C能形成高聚物,该高聚物的结构简式为。
(4)写出一种区分D和E的试剂。