某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为 :
(2)A与溴的四氯化碳溶液反应的化学方程式为
(3)已知: 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式 ;
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式 ;
反应类型是 ;
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式 ;
利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。
回答下列问题:
(1)步骤I中所用的试剂是___________。
(2)步骤III中反应的离子方程式是__________________________________。
(3)步骤V可选用的试剂是_________(填序号)。
a.NaOH溶液b.氨水 c.盐酸
(4)步骤VI的实验操作是_____________。
处理SO2废气的一种工艺流程如下图所示: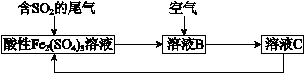
O2是氧化剂;(2)根据(1)的分析,得出:
根据流程,回答下列问题:
(1)溶液B与空气发生反应生成溶液C,其中氧化剂是________。
(2)SO2和酸性Fe2(SO4)3溶液反应的离子方程式是____________________________。
(3)推断Fe3+、O2和SO42−的氧化性由强到弱的顺序是_________________________。
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。
(1)CaO2溶于盐酸可得H2O2,反应的化学方程式是 。
(2)CaO2在保存时要密封,避免接触水蒸气和二氧化碳。水蒸气与CaO2反应的化学方程式是 。
(3)已知:CaO2在350℃迅速分解生成CaO和O2。取某CaO2样品10 g(含有少量CaO杂质),充分加热后剩余固体的质量为8.4 g,则该样品中CaO2的质量分数为 。
现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
已知反应I为:NaCl + CO2 + NH3 + H2O === NaHCO3↓+ NH4Cl
(1)工业生产中,制备NH3的化学方程式是_____________________________。
(2)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42−等离子。
① 为得到纯净的饱和NaCl溶液,进行了如下操作。请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中___________________________,过滤;
c.向滤液中___________________________,过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
② 步骤c中反应的离子方程式是______________________________。
(3)反应II的化学方程式是_________________________________。
(4)制得的纯碱中含有少量NaCl。取5.5 g纯碱样品加入足量稀硫酸,得到标准状况下1120 mL CO2。则样品中纯碱的质量分数是_________%(保留1位小数)。
Cl2是一种有毒气体,如果泄漏会造成严重的危害。
(1)已知:3Cl2+8NH3 === 6NH4Cl+ N2,化工厂可用浓氨水来检验Cl2是否泄漏。当有少量Cl2泄漏,可以观察到的现象是 。
(2)喷射石灰乳等碱性物质可以减轻少量Cl2泄漏造成的危害。Cl2和石灰乳反应的化学方程式是 。
(3)实验室常用烧碱溶液吸收Cl2。若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为8︰1时,混合液中NaClO和NaClO3的物质的量之比为 。