铝自然形成的氧化膜易脱落。以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强。其制备的简要流程如右图。下列用来解释流程中反应的方程式不正确的是
| A.碱洗目的是除去铝材表面的自然氧化膜:2OH- + Al2O3 ="==" 2AlO2- + H2O |
| B.碱洗时铝材表面会出现气泡:2Al + 2OH- + 2H2O ="==" 2AlO2- + 3H2↑ |
| C.获得耐蚀铝材的电极反应为:4Al – 12e- + 3O2 ="==" 2Al2O3 |
| D.用稀氨水洗去耐蚀铝材表面的酸:NH3·H2O + H+ ="==" NH4+ + H2O |
下列各图中,表示正反应是吸热反应的图是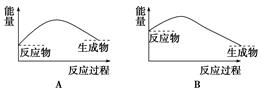
可逆反应A(g)+3B(g) 2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A.v(A)=0.15mol/(L·min) B.v (B)=0.6 mol/(L·min)
C.v (C)=0.3 mol/(L·min) D.v (D)=0.1 mol/(L·min)
不同的化学反应有不同的反应速率,决定化学反应速率的主要因素是
| A.温度 | B.浓度 | C.催化剂 | D.反应物的性质 |
在下列有关晶体的叙述中错误的是
| A.离子晶体中,一定存在离子键 | B.原子晶体中,只存在共价键 |
| C.金属晶体的熔沸点均很高 | D.稀有气体的原子能形成分子晶体 |
下列物质中,既有离子键又有共价键的是
| A.CaCl2 | B.KOH | C.H2O | D.HF |