草酸(H2C2O4)是一种二元弱酸,广泛分布于动植物体中。
(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一。有研究发现,EDTA(一种能结合金属离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因: 。
(2)已知:0.1 mol·L-1KHC2O4溶液呈酸性。下列说法正确的是 (填字母序号)。
a. 0.1 mol·L-1KHC2O4溶液中:c(K+) + c(H+) = c(HC2O4-) + 2c(C2O42-) + c(OH-)
b. 0.1 mol·L-1 KHC2O4溶液中:c(K+) > c(HC2O4-) > c(C2O42-) > c(H2C2O4)
c. 浓度均为0.1 mol·L-1 KHC2O4和K2C2O4的混合溶液中:2c(K+) = c(HC2O4-) + c(C2O42-)
d. 0.1 mol/L KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+) > c(Na+)
(3)利用草酸制备草酸亚铁晶体(FeC2O4·xH2O)的流程及组分测定方法如下:

已知:i. pH>4时,Fe2+易被氧气氧化
ii. 几种物质的溶解度(g /100g H2O)如下
| |
FeSO4·7H2O |
(NH4)2SO4 |
FeSO4·(NH4)2SO4·6H2O |
| 20℃ |
48 |
75 |
37 |
| 60℃ |
101 |
88 |
38 |
①用稀硫酸调溶液pH至1~2的目的是: , 。
②趁热过滤的原因是: 。
③氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M)。称取a g草酸亚铁晶体溶于稀硫酸中,用b mol·L-1的高锰酸钾标准液滴定,到达滴定终点时,消耗高锰酸钾VmL,则M = 。(已知:部分反应产物为Mn2+、Fe3+、CO2)
(8分,每空1分)(1)R、M两种元素所在周期的元素种类分别为n和m。若R的原子序数为x,当R、M均为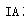 族元素,且M在R的下一周期时,M的原子序数为_______;当R、M均为
族元素,且M在R的下一周期时,M的原子序数为_______;当R、M均为 族元素且M在R的下一周期时,M的原子序数为_______。(用x、m、n的代数式表示)
族元素且M在R的下一周期时,M的原子序数为_______。(用x、m、n的代数式表示)
(2)在ds区中,族序数最大.原子序数最小的元素,其原子的价电子排布式为;第四周期中,未成对电子数最多的原子是(填元素符号),其未成对电子数是个。
(3)CH3+、-CH3都是很重要的有机反应中间体,它们的电子式分别是、;其中CH3+的键角应是。
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为:
(6分,每空1分)X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子L层电子数是K层电子数的2倍 |
| Y |
Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z |
Z存在质量数为23,中子数为12的核素 |
| W |
W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第___周期第___族,其基态原子最外层有___个电子。
(2)X元素基态原子的价电子的电子排布图为______________________;X的电负性比Y的____(填“大”或“小”);X和Y的气态氢化物中,较稳定的是______(写化学式)
按要求填空。(每空1分,共12分)
(1)E的一种核素的质量数为63,中子数为34.E的基态原子的核外电子排布式是_______基态E2+的核外电子排布式为___________E的某种化合物的结构如图所示。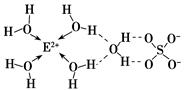
微粒间的相互作用包括化学键和分子间作用力,此化合物中各种粒子间的相互作用力有_______
(2)Se的基态原子价电子轨道表示式是_____;Mn2+离子的电子排布式_____;CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C.Si.H的电负性由大到小的顺序为_______。
(3)请写出与N元素的单质互为等电子体的分子.离子的化学式、_____(各写一种)氧元素与多种元素具有亲和力,所以形成化合物的种类很多①氧元素与氟元素能形成OF2分子,该分子的空间构型为___________②根据等电子原理,在NO2+离子中氮原子轨道杂化类型是_______;1molO22+中含有的p键数目为___________
(5)科学家把NaNO3和Na2O在一定条件下反应,得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各种原子的最外层电子都满足8电子稳定结构。该阴离子的电子式是___________
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:
CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 |
CH4 |
CO2 |
CO |
H2 |
| 体积分数 |
0.1 |
0.1 |
0.4 |
0.4 |
①此温度下该反应的平衡常数K=__________
②已知: 《1》CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=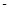 890.3 kJ·mol-1
890.3 kJ·mol-1
《2》CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
《3》2CO(g)+O2(g)=2CO2(g) △H=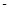 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是。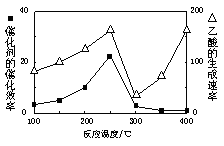
②为了提高该反应中CH4的转化率,可以采取的措施是。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为。
(3)①Li2O、Na2O、MgO均能吸收CO2。①如果寻找吸收CO2的其他物质,下列建议合理的是_____。
A.可在碱性氧化物中寻找
B.可在ⅠA、ⅡA族元素形成的氧化物中寻找
C.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是。
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O CO+H2+O2
CO+H2+O2
高温电解技术能高效实现(3)中反应A,工作原理示意图如下: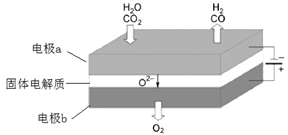
CO2在电极a放电的反应式是__________________________________________。
(共12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)Z原子的原子结构示意图为;
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式:;
(3)由X、Y、Z、W四种元素组成的一种正盐,该盐的水溶液呈酸性,用离子方程式解释原因:。
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。写出加热条件下乙与过量NaOH溶液反应的离子方程式。
(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为。该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为L。