高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
| A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+ |
| B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
某有机物的结构简式如下图所示,则下列有关说法正确的是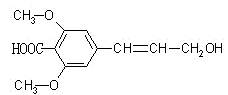
| A.该有机物可以发生氧化、加成、加聚、取代等反应 |
| B.该有机物能与NaOH溶液反应,则1mol该有机物能消耗2molNaOH |
| C.该有机物的分子式为C12H14O5,且与C11H12O5 一定互为同系物 |
| D.该有机物分子中所有碳原子不可能都在同一平面上 |
已知H2A为弱酸,下列说法错误的是
A.0.1mol/L的Na2A溶液中:c(A2-)+c(HA-)+ c(H2A)= 0.1mol/L
B.常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液的pH<5
C.常温下,将pH=3的H2A溶液与pH=11的NaOH溶液等体积混合,反应混合液呈酸性
D.常温下,若1mol/L的NaHA溶液的pH=9,则溶液中:c(Na+)-c(HA-)-c(A2-)=10-5-10-9
某链状有机物的分子式为C4H8O2,若该有机物能与NaOH溶液反应,则其同分异构体共有(不考虑立体异构)
| A.2种 | B.4种 | C.6种 | D.8种 |
根据下图实验装置判断,下列说法正确的是
| A.该装置能将电能转化为化学能 |
| B.活性炭为正极,其电极反应式为: 2H++2e-=H2↑ |
| C.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
| D.装置内总反应方程式为:4Al+3O2 +6H2O = 4Al(OH)3 |
下列说法正确的是
| A.汽油、柴油、植物油都属烃类物质且均为纯净物 |
| B.单质硅常用于制造芯片和光导纤维 |
| C.等质量的气态乙醇和液态乙醇分别完全燃烧,前者放出的热量更多 |
| D.漂白精和明矾都常用于自来水的处理,二者作用原理相同 |