Cl2及其化合物在生产、生活中具有广泛的用途

(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图1所示。
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是__________。
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为____________。
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的化学方程式____________。
(3)工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2。电解时,NaClO3在_____极(填阴或阳)生成,生成ClO3–的电极反应式为__________________。
(4)一定条件下,在水溶液中 1 mol Cl–、1mol ClOx–(x=1,2,3,4)的能量大小与化合价的关系如图2所示
①从能量角度看,C、D、E中最不稳定的离子是 (填离子符号)。
②B → A + D反应的热化学方程式为 (用离子符号表示)。
已知烯烃、炔烃在臭氧的作用下发生以下反应:
CH3-CH=CH-CH2-CH=CH2 CH3CHO+OHC-CH2-CHO+HCHO
CH3CHO+OHC-CH2-CHO+HCHO
CH3-C C-CH2-C
C-CH2-C CH
CH CH3COOH+HOOC-CH2-COOH+HCOOH
CH3COOH+HOOC-CH2-COOH+HCOOH
某烃分子式为C10H10,在臭氧作用下发生反应:
C10H10 CH3COOH+3HOOC-CHO+CH3CHO
CH3COOH+3HOOC-CHO+CH3CHO
(1) C10H10分子中含有个双键,个三键。
(2) C10H10分子结构简式为。
(1)分子式为C7H8O的芳香族化合物中,与FeCl3溶液混合后显紫色和不显紫色的物质分别有3种和2种,各写出其中的一种(写出结构简式):;。
举出学过的2个例子说明芳香化合物侧链对苯环的影响,用化学方程式表示;。
以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度, 若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图所示。请回答下列问题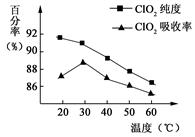
(1)据图可知,反应时需要控制的适宜温度是℃,达到此要求采取的适宜措施是。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式:。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500mol· (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol· K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+=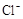 +5Fe3+ +2H2O14H+ +
+5Fe3+ +2H2O14H+ +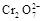 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
①2Ca3(PO4)2(s)+10C(s) 6CaO(s)+P4(s)+10CO(g)ΔH1="+3" 359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g)ΔH1="+3" 359.26 kJ·mol-1
②CaO(s)+SiO2(s) CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s) 6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3=kJ·mol-1。
6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3=kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示: 11P4+60CuSO4 +96H2O 20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是。
20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。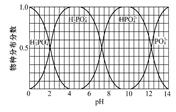
①为获得尽可能纯的NaH2PO4,pH应控制在; pH=8时,溶液中主要含磷物种浓度大小关系为。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是(写离子方程式)。
(4)磷的化合物三氯氧磷(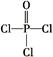 )与季戊四醇(
)与季戊四醇(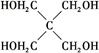 )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
①酸性气体是(填化学式)
②X的结构简式为。
碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32- 2I-+ S4O62-(快)
2I-+ S4O62-(快)
向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-)。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 |
体积V/mL |
||||
| K2S2O8溶液 |
水 |
KI溶液 |
Na2S2O3溶液 |
淀粉溶液 |
|
| ① |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
| ② |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
| ③ |
8.0 |
Vx |
4.0 |
4.0 |
2.0 |
表中VxmL,理由是。
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:2Li(s)+I2(s) 2LiI(s)ΔH
2LiI(s)ΔH
已知:①4Li(s)+O2(g) 2Li2O(s)ΔH1②4LiI(s)+O2(g)
2Li2O(s)ΔH1②4LiI(s)+O2(g) 2I2(s)+2Li2O(s)ΔH2
2I2(s)+2Li2O(s)ΔH2
则电池反应的ΔH=;碘电极作为该电池的极。