碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32- 2I-+ S4O62-(快)
2I-+ S4O62-(快)
向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 |
体积V/mL |
||||
| K2S2O8溶液 |
水 |
KI溶液 |
Na2S2O3溶液 |
淀粉溶液 |
|
| ① |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
| ② |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
| ③ |
8.0 |
Vx |
4.0 |
4.0 |
2.0 |
表中Vx mL,理由是 。
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:2Li(s)+I2(s) 2LiI(s)ΔH
2LiI(s)ΔH
已知:①4Li(s)+O2(g) 2Li2O(s) ΔH1 ②4LiI(s)+O2(g)
2Li2O(s) ΔH1 ②4LiI(s)+O2(g) 2I2(s)+2Li2O(s)ΔH2
2I2(s)+2Li2O(s)ΔH2
则电池反应的ΔH= ;碘电极作为该电池的 极。
A、B、C、D、E、F、G七种物质间存在如图所示转化关系,其中A、B、D、G含有同种元素。
已知
(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液。
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
(Ⅲ)D能将某种氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)上述反应中属于置换反应的是(填序号)。
(2)G生成B的过程中所出现的现象;
反应③的离子方程式。
(3)D的水溶液显酸性,请用离子方程式解释原因。
(4)实验室制取C的化学方程式为;
对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023 个。请按照要求填空:
| 实验步骤 |
实验现象 |
用化学用语解释 |
| 将少量气体通入淀粉KI溶液 |
溶液最初变成色 |
(用离子方程式表示) |
| 继续通入气体 |
溶液逐渐变成无色 |
(用化学方程式表示) |
现有等物质的量的NaHCO3、KHCO3的混合物a g与100mL盐酸反应。题中涉及的气体体积均以标准状况计,填空时可以用带字母的公式表示。
(1)该混合物中NaHCO3与KHCO3的质量比为。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为mol·L-1。
(3)如果盐酸过量,生成CO2的体积为L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积范围是。
A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):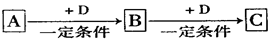
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为(填元素符号)
(2)若D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程
式表示);D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式。
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式。化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E 的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示。则固体混合物中Mg的质量为;NaOH溶液的物质的量浓度为。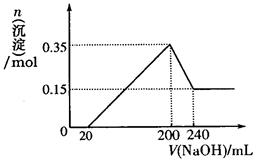
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。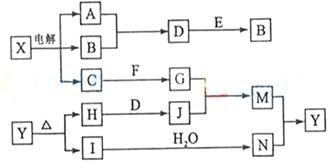
请回答下列问题:
(1)B中所含元素位于周期表中周期族
(2)A在B中燃烧的现象是。
(3)D+E→B的反应中,n(被氧化的物质):n(被还原的物质)=。
(4)G+J→M的离子方程式是。
(5)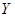 受热分解的化学方程式是。
受热分解的化学方程式是。
铁是日常生活中用途最广、用量最大的金属材料。
(1)常温下,可用铁质容器盛装浓硫酸的原因是。
(2)某实验小组利用右图装置验证铁与水蒸气的反应。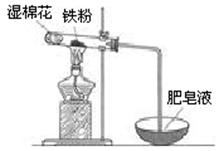
①湿棉花的作用是,试管中反应的化学方程式是。
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,固体完全溶解,所得溶液中存在的阳离子是(填序号)。
a.一定有Fe2+、H+和Fe3+ b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有 H+ d.一定有Fe3+、H+,可能有Fe2+
(3)另称取一定量的铁钉放入适量的浓硫酸中,加热,充分反应后收集气体。经测定气体中含有SO2、CO2和H2。
①铁与浓硫酸反应的化学方程式是。
②气体中混有CO2的原因是(用化学方程式表示)。
③将672 mL(标准状况)收集到的气体通入足量溴水中,发生反应:
SO2 + Br2 + 2H2O =" 2HBr" + H2SO4,然后加入足量BaCl2溶液,经洗涤、干燥得到固体4.66 g。由此推知收集到的气体中SO2的体积分数是。