A、B、C、D、E五种常见元素的核电荷数依次增大。A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素, D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子。请回答下列问题:
(1)E的基态原子价层电子排布式为 。
(2)AB2分子中,A的杂化类型为 ;在元素周期表中A、B及与两者紧邻的元素的第一电离能由大到小的顺序为(用元素符号表示) 。
(3)B的氢化物与D的氢化物的沸点较高的是 (用化学式表示),原因是 。
(4)AB2形成的晶体的熔点 (填“高于”“低于”或“无法判断”)CD形成的晶体的熔点,原因是 .
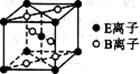
(5)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为 (用元素符号表示)。ED4是制取航天航空工业材料的重要原料。取上述橙红色晶体,放在电炉中,通入D2和A的单质后高温加热,可制得ED4,同时产生一种造成温室效应的气体,写出反应的化学方程式 。
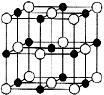
(6)由C、D两元素形成的化合物组成的晶体中,晶胞结构图以及晶胞的剖面图如下图所示,若晶胞边长是acm,则该晶体的密度为 g·cm-3。(已知阿伏伽德罗常数为NA)。
“西气东输”是西部开发的重点工程,这里的气是指天然气,其主要成分是甲烷。工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,两者的体积比约为1∶1。已知1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;1molH2完全燃烧生成液态水放出286 kJ热量;1molCH4气体完全燃烧生成CO2气体和液态水放出890kJ热量。
(1)写出H2完全燃烧生成液态水的热化学反应方程式:__________________,若1molCH4气体完全燃烧生成CO2气体和水蒸气,放出的热量____________890kJ(填“> ”“=”或“<”)。
(2)忽略水煤气中其他成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为____________;燃烧生成的CO2的质量比约为____________。
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是________________________________________________。
家用液化气中的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧反应的热化学方程式:________________________。已知1 mol 液态水汽化时需要吸收44 kJ的热量,则1 mol 丁烷完全燃烧并生成气态水时放出的热量为______kJ。
“西气东输”是西部大开发的重点工程,这里的“气”指天然气,其主要成分为甲烷。
(1)工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,它们的体积比约为1∶1。已知:
2CO(g)+O2(g) 2CO2(g) ΔH=-566kJ·mol-1
2CO2(g) ΔH=-566kJ·mol-1
2H2(g)+O2(g) 2H2O(l) ΔH=-572kJ·mol-1
2H2O(l) ΔH=-572kJ·mol-1
CH4(g)+2O2(g)  CO2(g)+2H2O(l) ΔH=-890kJ·mol-1
CO2(g)+2H2O(l) ΔH=-890kJ·mol-1
若不考虑水煤气中其他成分,相同状况下要获得相等的热量,所需甲烷与水煤气的体积比约为_________,它们燃烧生成的CO2的物质的量之比约为______________。
以甲烷代替水煤气作民用燃气,其优点是_________。
(2)某化工生产中用烷烃和水蒸气反应得到CO和H2为主的混合气,这种混合气可用于生产甲醇或合成氨,对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g) CO(g)+2H2(g) ΔH1=-36kJ·mol-1
CO(g)+2H2(g) ΔH1=-36kJ·mol-1
②CH4(g)+H2O(g) CO(g)+3H2(g) ΔH2=+216kJ·mol-1
CO(g)+3H2(g) ΔH2=+216kJ·mol-1
由反应①②推出总反应热为零的总反应方程式为____________________________;求进料气中空气(O2的体积分数为21%)与水蒸气的体积比__________。
(8分)已知A~K均为中学化学中常见的物质,它们之间有如下图所示的转化关系,其中A为两种物质组成的混合物,H、I、K为单质,H是气体,G是红褐色沉淀。(反应过程中生成的水及其他产物没有列出)
请回答以下问题:
(1)写出下列物质的化学式:H____________,J____________。
(2)写出A跟盐酸混合反应生成B的化学方程式:______________________。
(3)写出C跟氯气反应生成E的化学方程式:______________________。
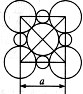
美国《科学》杂志评选的2001年十大科技进展之一是当年科学家发现了一种在接近40 K的温度下成为超导材料的硼镁化合物。这种硼镁超导物质的晶体结构单元如图5-6所示:
图5-6
(1)试写出这种超导材料的化学式________________________。
(2)完成并配平下列化学反应方程式。
(3)写出B4H10在空气中燃烧的化学方程式。
(4)假设硼镁超导材料晶体结构中的边长为a cm,棱长为b cm,试求此晶体的密度。