X、Y、Z和W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在周期表中,Z与Y、W均相邻;Y、Z和W三种元素的原子最外层电子数之和为17。则下列有关叙述正确的是 ( )
| A.Y、Z和W三种元素可能位于同一周期 |
| B.上述元素形成的氢化物中,W的氢化物相对分子质量最大,熔沸点最高 |
| C.Y和W所形成的含氧酸均为强酸,是离子化合物 |
| D.X、Y、Z和W可以组成原子的物质的量之比为5∶1∶4∶1的离子化合物 |
12.能正确表示下列反应的离子方程式是
| A.乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH- → CH3COOH+ C2H5O- |
B.用银氨溶液检验乙醛的醛基:CH3CHO +2Ag(NH3)2+ + 2OH-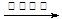 CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O |
C.向苯酚钠溶液中通入少量的CO2:CO2 + H2O + 2C6H5O- 2C6H5OH + 2CO32- 2C6H5OH + 2CO32- |
D.甘氨酸与氢氧化钠溶液反应: |
8.下表中实验操作能达到实验目的的是
| 实验操作 |
实验目的 |
|
| A |
向甲酸钠溶液中加新制的Cu(OH)2并加热 |
确定甲酸钠中含有醛基 |
| B |
向苯酚的饱和溶液中滴加少量稀溴水 |
制备三溴苯酚 |
| C |
向酒精和醋酸的混合液中加入金属钠 |
确定酒精中混有醋酸 |
| D |
将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 |
检验水解产物中的溴离子 |
15.CPAE是蜂胶的主要活性成分,也可由咖啡酸合成
下列说法不正确的是
| A.该反应是取代反应 |
| B.可用金属Na检测上述反应是否残留苯乙醇 |
| C.咖啡酸不能使酸性KMnO4溶液褪色 |
| D.1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH |
14.某有机物的结构简式为 ,它在一定条件下可能发生的反应是
,它在一定条件下可能发生的反应是
①加成;②水解;③酯化;④氧化;⑤中和;⑥消去;⑦还原
| A.①③④⑤⑥⑦ | B.①③④⑤⑦ | C.①③⑤⑥⑦ | D.②③④⑤⑥ |
13.用括号内的试剂和方法除去下列各种物质中的少量杂质,可行的是
| A.乙酸乙酯中的乙酸(NaOH溶液,分液) | B.乙醇中的乙酸(浓硫酸并加热) |
| C.苯中的溴(NaOH溶液,分液) | D.苯中的苯酚(溴水,过滤) |